南湖新闻网讯(通讯员 胡树繁 )7月17日,我校生物医学与健康学院、生命科学技术学院李姗教授课题组以“Arg-GlcNAcylation of TRADD by NleB and SseK1 is crucial for bacterial pathogenesis” 为题,在Frontiers in Cell and Developmental Biology杂志发表研究论文。文章揭示A/E致病菌通过三型分泌系统效应蛋白NleB/SseK1操纵TRADD介导的信号传导,进而逃避宿主的免疫防御机制,为后续相关的研究提供新思路。
肠致病性大肠杆菌(EPEC)和鼠伤寒沙门氏菌(S. Typhimurium)是重要的食源性细菌,两者均分泌具有Arg-GlcNAc转移酶活性的三型分泌系统效应蛋白NleB/SseKs。精氨酸 N-乙酰葡萄糖胺化修饰是一种全新的翻译后修饰,可作用于宿主细胞的死亡结构域,抑制宿主死亡受体所介导的细胞死亡。人类基因组中的死亡受体结构域蛋白,多数也都与炎症反应或者细胞死亡信号通路有关。对所有的死亡结构域进行比对,发现有三分之一的蛋白在TRADD的第235位精氨酸所对应的位置拥有保守的精氨酸。
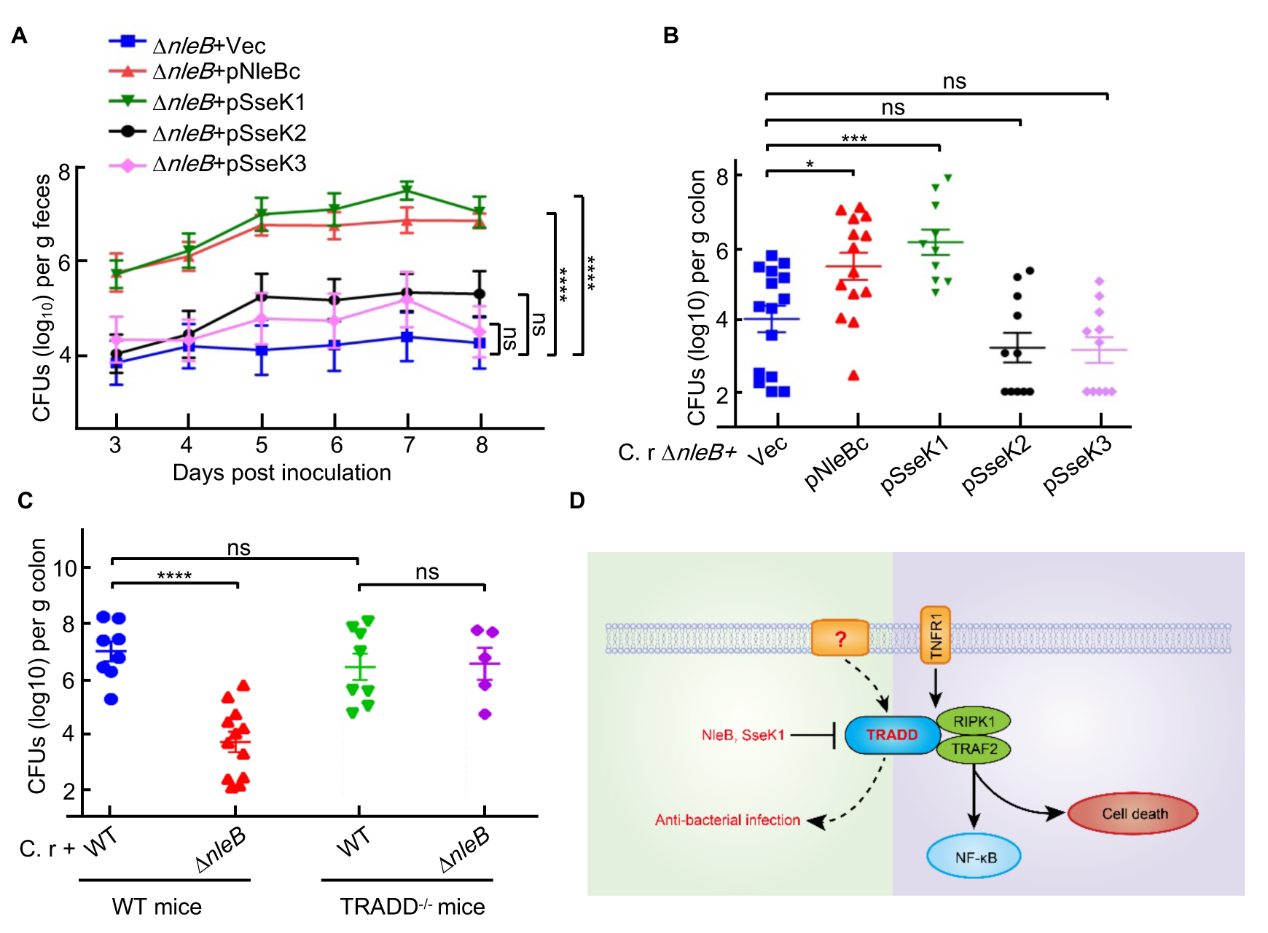
基于上述发现,李姗课题组在EPEC和沙门氏菌感染期间对含有保守的精氨酸的12个死亡域蛋白进行有限的底物筛选,以鉴定NleB/SseK的生化活性及生理底物。结果发现,EPEC的NleB可修饰TRADD DD,FADD和RIPK1 DD,沙门氏菌的SseK1和SseK3分别通过TRADD Arg235/Arg245和TNFR1 Arg376劫持死亡受体信号。且SseK1完全消除了TRADD过表达诱导的NF-κB激活和细胞凋亡。NleB在体外的底物存在广泛性,然而体内的生理底物一直是未解之谜。利用SseK1和SseK3的底物特异性,在小鼠感染模型中,课题组发现,只有SseK1可以回补细菌定植缺陷,而SseK3是不能的,并且TRADD缺失小鼠也证明TRADD是细菌感染过程中NleB的靶标。SseK3可靶向TRADD的上游受体TNFR1破坏TNF信号传导。 但抑制TRADD而不是TNFR1有利于细菌定植,这一发现也强调了TRADD在TNFR1和non-TNFR1信号转导中的抗菌感染作用。
本项目受到科技部重点研发计划、国家自然科学基金、华中农业大学自主创新基金以及十堰市太和医院人才启动基金支持。李姗为该论文通讯作者,硕士研究生胡树繁,黄宇轩,张琦,易雪莹,博士研究生潘兴有重要贡献。
2020年以来,李姗课题组在前期工作基础上(Liet al., Nature, 2013; Dinget al., Molecular Cell, 2019),先后发表论文揭示NleB/SseK糖基化自修饰的生理功能(Xue et al., Frontiers in Cellular and Infection Microbiology, 2020), SseK3全新的底物筛选及功能研究(Meng et al., Communications Biology, 2020),并发文综述精氨酸糖基化修饰类型及反应机理(Pan et al., Frontiers in Cellular and Infection Microbiology, 2020)。
原文链接:https://www.frontiersin.org/articles/10.3389/fcell.2020.00641/full
审核 : 李姗

