南湖新闻网讯(通讯员 吴阳)近日,我校农业微生物国家重点实验室韩鹤友教授课题组在纳米抗超级细菌研究上取得新进展。该研究不使用任何抗生素,因此不会导致细菌产生耐药性。
抗生素的滥用导致细菌产生了严重的耐药性,而多重耐药性的超级细菌更是对人类健康构成了极其重大的威胁。目前,临床上的超级细菌是指“ESKAPE”,(E.faecium(屎肠球菌);S.aureus(金黄色葡萄球菌);K.pneumoniae(肺炎克雷伯菌) ;A. baumannii (鲍氏不动杆菌) ;P.aeruginosa(铜绿假单胞菌);E.species(肠杆菌) )。其中,铜绿假单胞菌是一种常见的医院污染物,是囊性纤维化患者和免疫功能低下患者发病和死亡的主要原因,对大部分抗生素具有抗药性,而且能快速地产生抗药性突变,因此,根除铜绿假单胞菌,具有重要意义。
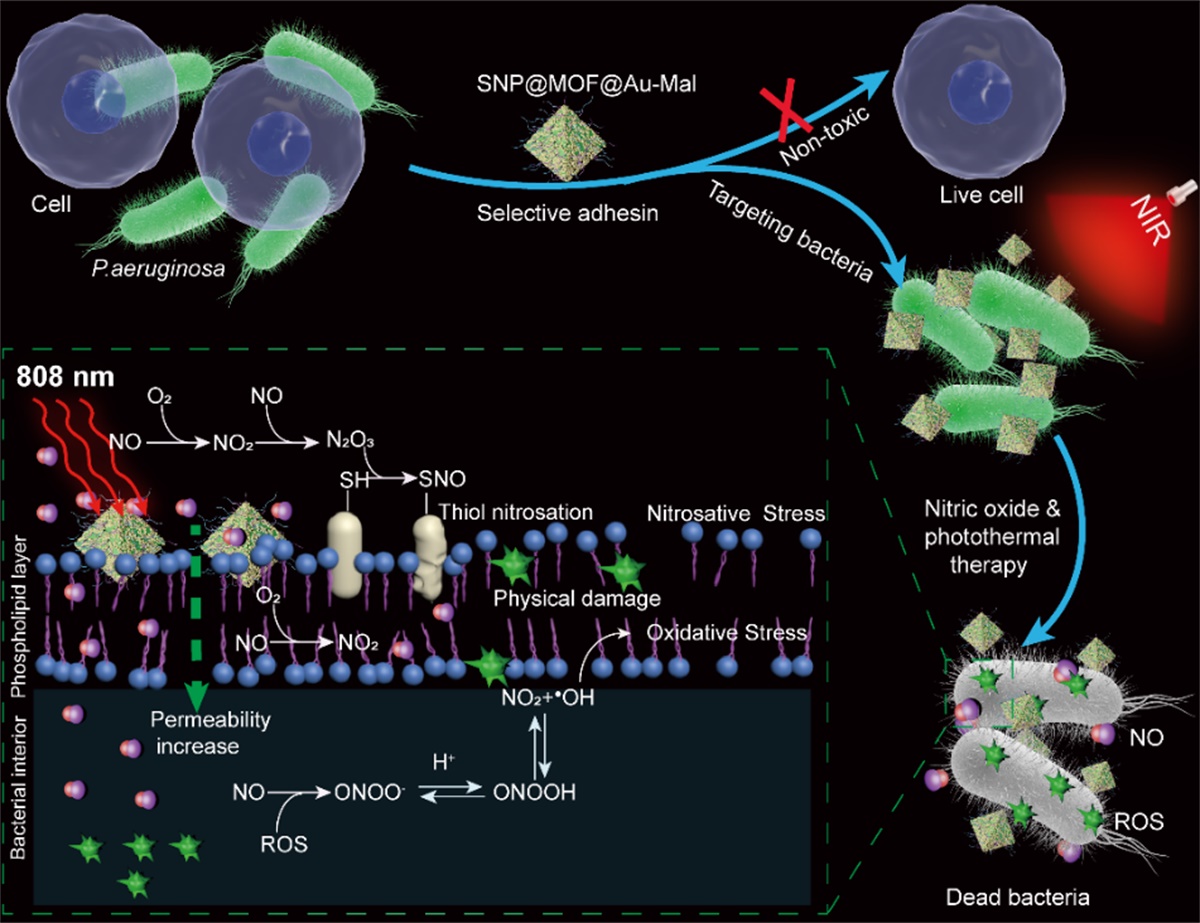
韩鹤友教授团队利用一氧化氮(NO)的生物信使分子特性和马来酰亚胺分子可靶向铜绿假单胞菌T4P菌毛的识别特性,构建了近红外光(NIR)触发的智能NO纳米发生器,实现对铜绿假单胞菌的精准高效治疗。
该研究主要包括以下几点创新内容。纳米发生器可通过SNP @MOF @ Au-Mal马来酰亚胺与细菌T4P菌毛结合,增加细菌膜的通透性,对细菌膜造成物理性损伤,并为下一步精确治疗细菌感染创造条件。此外,原位产生的NO与光热诱导产生的ROS反应生成更强氧化性的ONOO-;在细菌细胞附近局部释放的高浓度NO,进一步促进更多的NO及其相关衍生物向细胞转移,极大地提高了NO抗超级细菌的效果,实现“1+1大于2”的协同抗菌作用。下图活体实验证明,纳米发生器可以富集在伤口部位,在NIR光照射下伤口部位的温度明显升高,有利于NO的释放。在相同的总NO浓度条件下,更快的NO释放比较慢的NO释放将产生更强的细菌杀伤作用。实验结果还表明,光照后伤口处的NO浓度明显增加,伤口面的细菌数量减少了97.7%,促进了伤口的愈合。
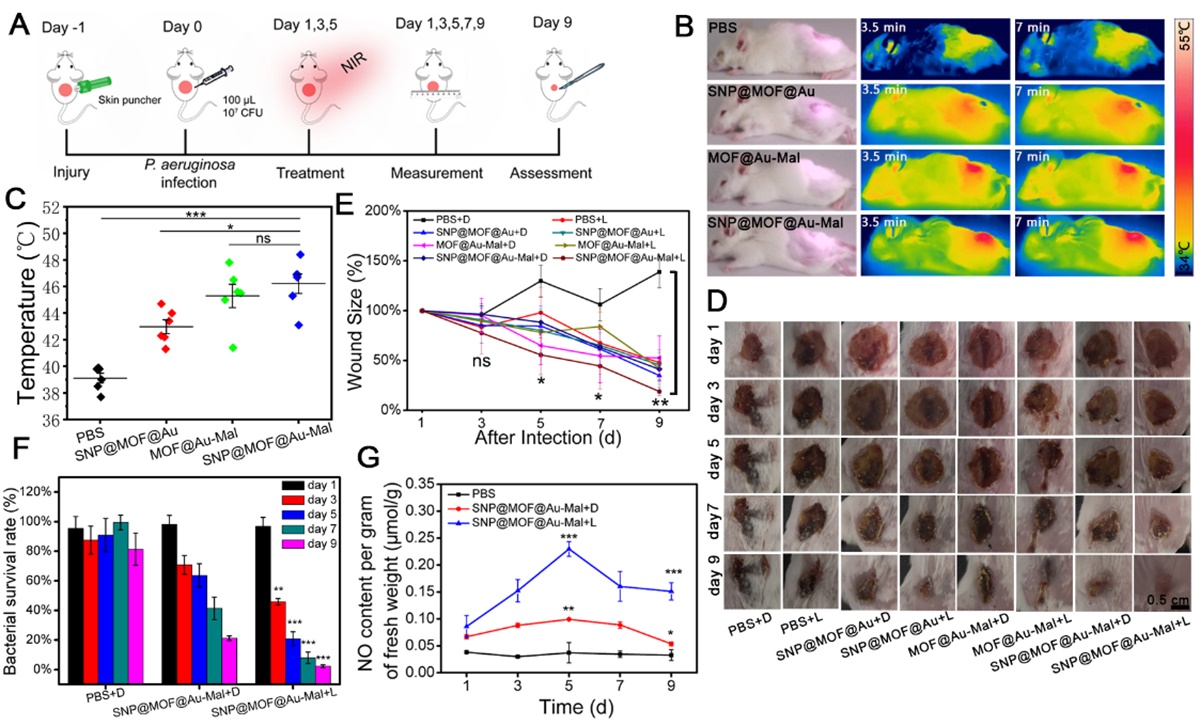
实验结果还表明,在活体治疗的早期,纳米发生器可以杀死细菌,但不需要M1巨噬细胞释放过量的促炎因子(TNF-α,IL-1,NO等),其结果有利于缩短巨噬细胞向M1的极化时间,避免产生过度炎症,有利于M1巨噬细胞提前向M2巨噬细胞极化,从而起到保护宿主免受过度伤害和促进损害修复的作用。实验结果进一步表明,该纳米发生器可以促进生长因子(IGF, TGF-β等)的分泌,这在调节炎症和诱导血管生成中起关键作用,在伤口愈合过程中基质形成和重塑过程至关重要。
综上,纳米抗超级细菌策略(不使用抗生素),有望在不产生耐药性的情况下治疗细菌感染,为临床上解决多重耐药性的超级细菌提供了新的思路。该研究得到国家自然科学基金、校自主创新基金等的资助,是该团队继2018年、2019年及2020年在纳米抗超级细菌研究的又一重要进展。
论文链接:https://doi.org/10.1016/j.biomaterials.2020.120588
原文摘要(Abstract)
Nitric oxide (NO) is an importantbiological messenger involved in the treatment of bacterial infections, but itscontrolled and targeted release in bacterial infections remains a major challenge.Herein, an intelligent NO nanogenerator triggered by near-infrared (NIR) lightis constructed for targeted treatment ofP. aeruginosabacterialinfection. Since maleimide can recognize and attach to the pilus of T4PofP. aeruginosa, we adopt this strategy to achieve the accuraterelease of therapeutic drugs at the infection site, i.e., after maleimidetargets Gram-negative bacteria, the SNP@MOF@Au-Mal nanogenerator willrelease NO and generate ROSin situfrom the inorganicphotosensitizer gold nanoparticles under NIR irradiation to achieve synergisticantibacterial effect.In vivoexperiments proved that thebacterial burden on the wound was reduced by 97.7%. Additionally, thenanogenerator was shown to promote the secretion of growth factors, which playa key role in regulating inflammation and inducing angiogenesis. This strategyhas the advantage of generating a high concentration of NOin situtopromote the transfer of more NO and its derivatives (N2O3, ONOO−) to bacteria, thereby significantlyimproving the antibacterial effect. The multifunctional antibacterial platformhas been demonstrated as a good carrier for gas therapy because of its simpleand efficient gas release performance, indicating its great potential for thetreatment of drug-resistant bacterial infections.
审核人:韩鹤友

