南湖新闻网讯(通讯员 张金)研究表明,药物分子的活性和利用度与其在溶液中的分子状态息息相关。卟啉类药物具有的大π共轭结构分子在溶液中处于分散状态时,具有良好的光动力治疗活性;而在聚集状态时,其光动力治疗性质丢失转而产生高的光热效应,实现肿瘤的光热治疗。近年来,由于联合不同的治疗方式会造成协同治疗也受到人们了广泛关注,因此,充分智能化利用药物分子在溶液中状态的改变,实现肿瘤多种治疗方式的联合,达到“1 + 1 > 2”的超加效应,为肿瘤的精准治疗提供新策略。
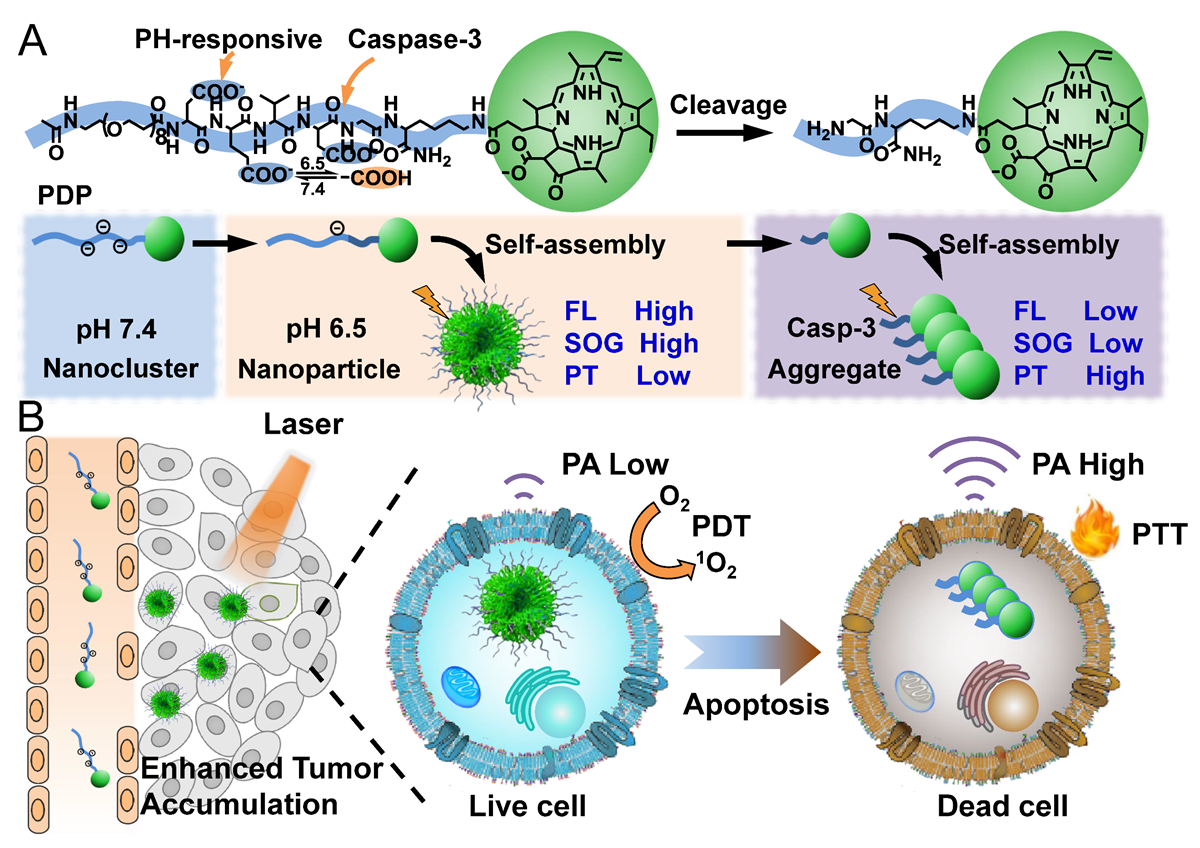
图 1. PDP用于肿瘤协同治疗的示意图
(A) PDP的化学结构式及其响应Caspase-3聚集的示意图;(B) 分散良好的PDP进入肿瘤细胞后具有良好的光活性,能通过光动力治疗诱导肿瘤细胞死亡;随后,死亡的肿瘤细胞能使PDP由分散状态变为聚集状态,使其能用于光热治疗和光声成像肿瘤凋亡。
我校韩鹤友教授课题组从卟啉类光敏剂(PPa)的分子状态入手,构建了一个能响应肿瘤凋亡的“分子状态”转换颗粒(PDP)。该颗粒中的卟啉光敏剂在正常生理条件下为分散性良好的纳米颗粒(图1A),具有高的光动力治疗效果,能有效用于肿瘤的光动力治疗。随后,当光动力治疗诱导细胞凋亡后,凋亡细胞的产生caspase-3酶能快速切裂PDP的亲水片段,诱导分散状态的PPa转为聚集状态PPa,产生高的光热效率,有利于肿瘤的光热治疗(图1B)。同时,这种变化还能产生高的光声信号,也为光声评估肿瘤凋亡提供了可能。这种新型分子状态转换纳米颗粒的构建大大减少繁琐的合成步骤,为高效的肿瘤治疗和评估提供了思路。
体外实验中,通过红外图谱(图2A),在不同的pH下,PDP侧链上的羧酸根会逐渐质子化。HPLC揭示在PDP在caspase-3条件下能被有效裂解(图2B)。图2D的临界胶束浓度测试也证实PDP的质子化和caspase-3的裂解会增强PDP的疏水性。电子透射成像(图2E)表明PDP的疏水性变化的确会导致其分子状态改变,在pH 7.4的时候是直径约为10 nm左右的纳米颗粒,在pH 6.5时为更大尺寸的纳米颗粒,而在caspase-3下出现了明显的聚集。荧光、紫外及ROS生成表征(图2F,G和H)进一步表明在pH 7.4和6.5时,该PDP中光敏剂分子是处于单体状态的(其Qy带在667 nm处并具有高的荧光活性和ROS生成能力),而在caspase-3条件下,PPa的分子状态表现为显著聚集特征(其Qy带在683 nm处并具有低的荧光活性和ROS生成能力),证实了该纳米颗粒能响应肿瘤凋亡酶caspase-3,实现光敏剂PPa分子状态的变化(图2)。
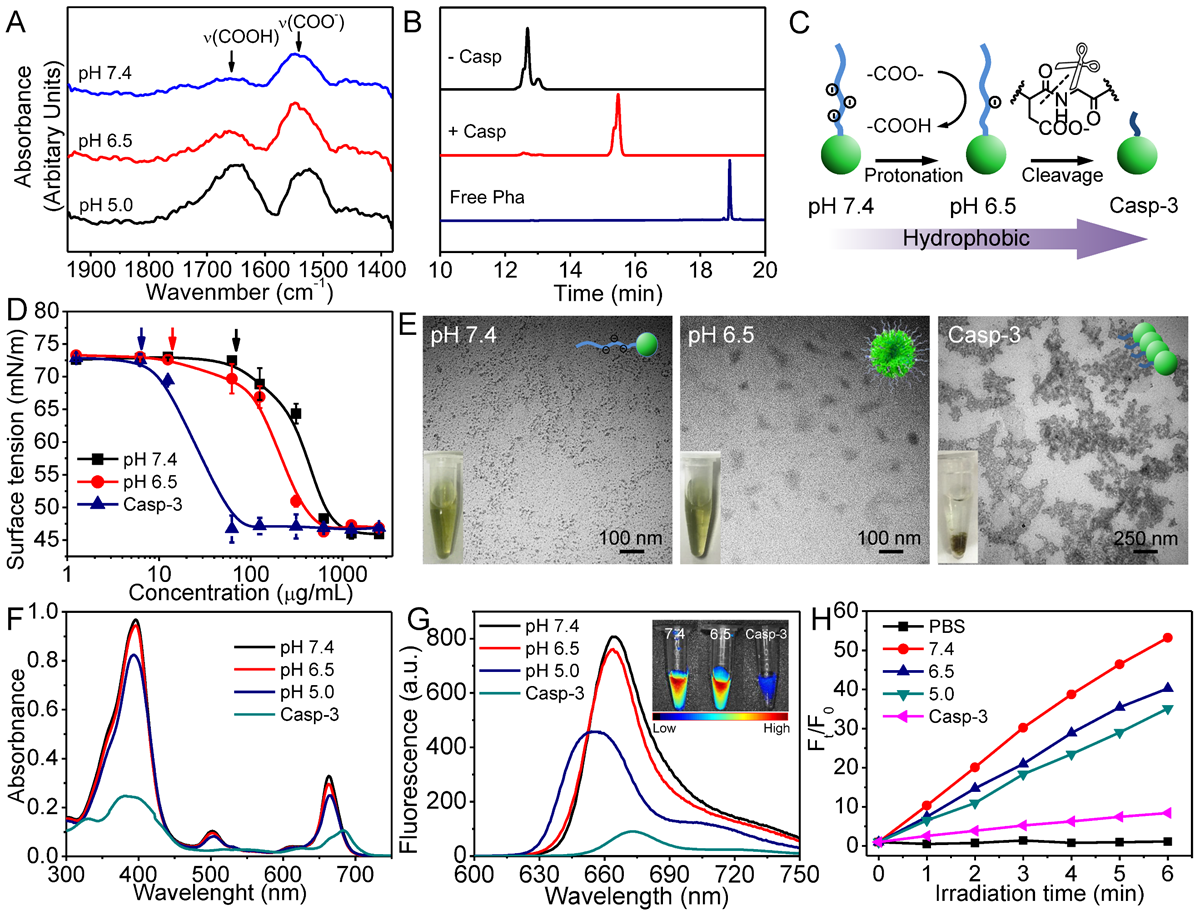
图 2. PDP响应性聚集行为调查
(A) PDP 在不同 pH 值下的 红外光谱。(B) PDP(黑色)、caspase-3处理的PDP(红色)和游离的Pha(蓝色)的 HPLC 图谱。(C)分子聚集机制的示意图。(D)不同pH值下PDP 的临界聚集浓度评估。在 pH 7.5、pH 6.5 和 caspase-3 条件下的(E)TEM 图像,(F)UV-Vis 吸收光谱,(G)荧光光谱及ROS 生成。为了进一步说明酸度对 PDP 的影响,使用较低 pH (5.0) 的 PDP 作为阳性对照组。(E)中的插图是在高浓度PDP和长孵育时间条件下的溶液光学照片。 (G) 中的插图是 PDP 溶液的荧光成像。
PDP在体内协同抗击肿瘤的实验结果表明,相比于对照组小鼠和单次治疗的小鼠,经过联合治疗小鼠的肿瘤几乎被完全抑制住了(图3B和C),且具有更高的存活率(图3D)。图3E的H&E和TUNEL染色结果也表明经联合光疗的小鼠肿瘤组织中也具有更高的细胞损伤状况。同时,通过生化分析评估材料对小鼠的毒副作用实验,结果表明各组小鼠的心、肾和肝功能等指标和空白组相当(图3F),进一步证实了该分子状态转变纳米颗粒具有很好的活体治疗的安全性。
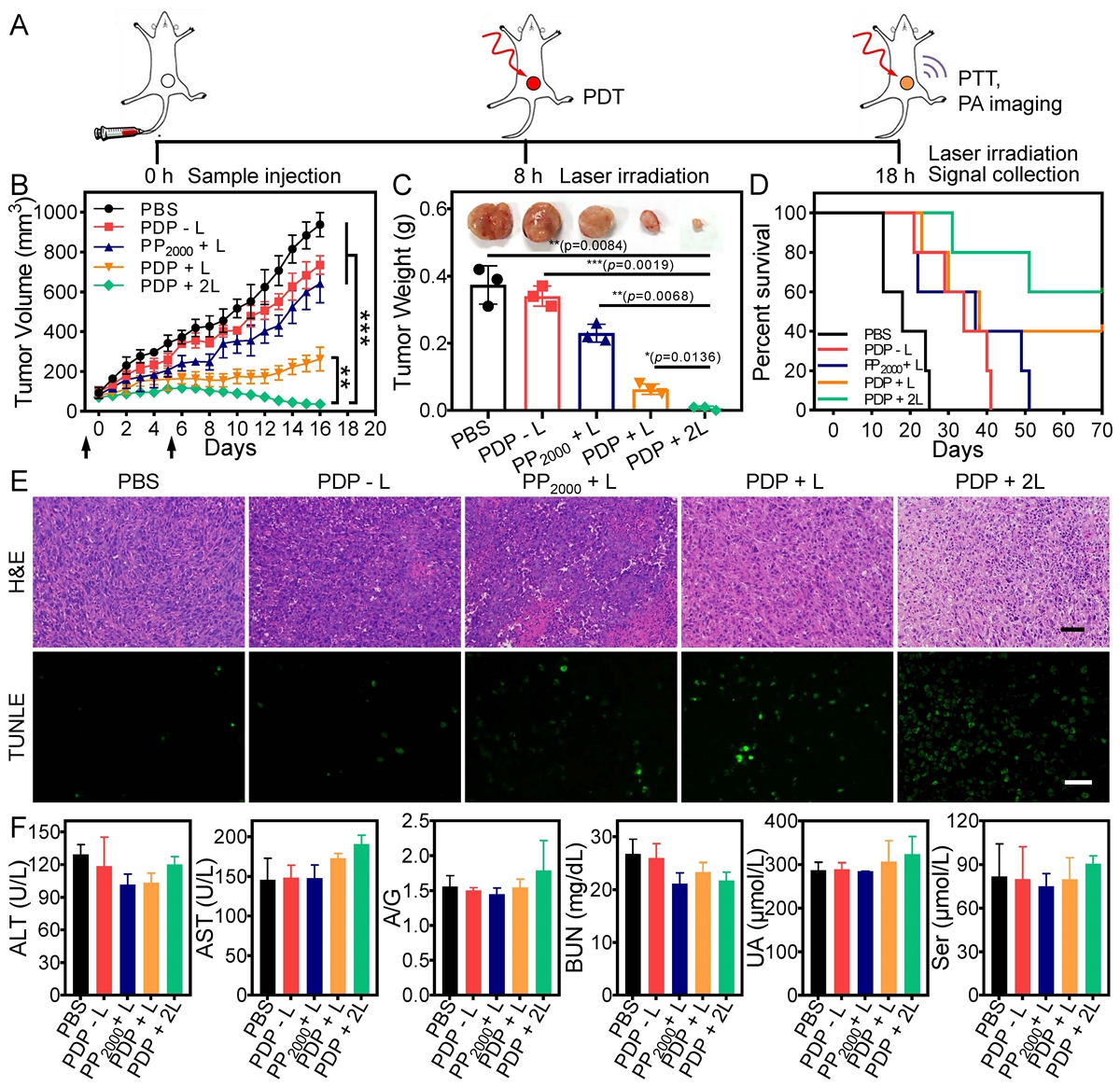
图3
图 3. (A) 协同光疗及光声评估肿瘤凋亡的工作流程图。(B)不同处理组的肿瘤生长随时间变化的曲线。(C)治疗结束后的平均肿瘤重量。插图为治疗后从不同组收集的肿瘤照片。(D) 不同组小鼠的存活曲线。(E) 治疗结束时不同组肿瘤切片的 H&E 染色和 TUNEL 分析。比例尺为 50 μm。(F)治疗后各种样品血清的血液生化分析。
本研究更重要的意义在于聚集状态的PPA具有更高的光热效应,可将其用于现场光声评估肿瘤的凋亡情况,图4A和B的结果表明,在光动力治疗后肿瘤的光声信号;通过线扫分析表明该光声信号主要集中在肿瘤表皮处(图4C),证实了PDP能作为一个高效的光声探针用于治疗响应的评估。
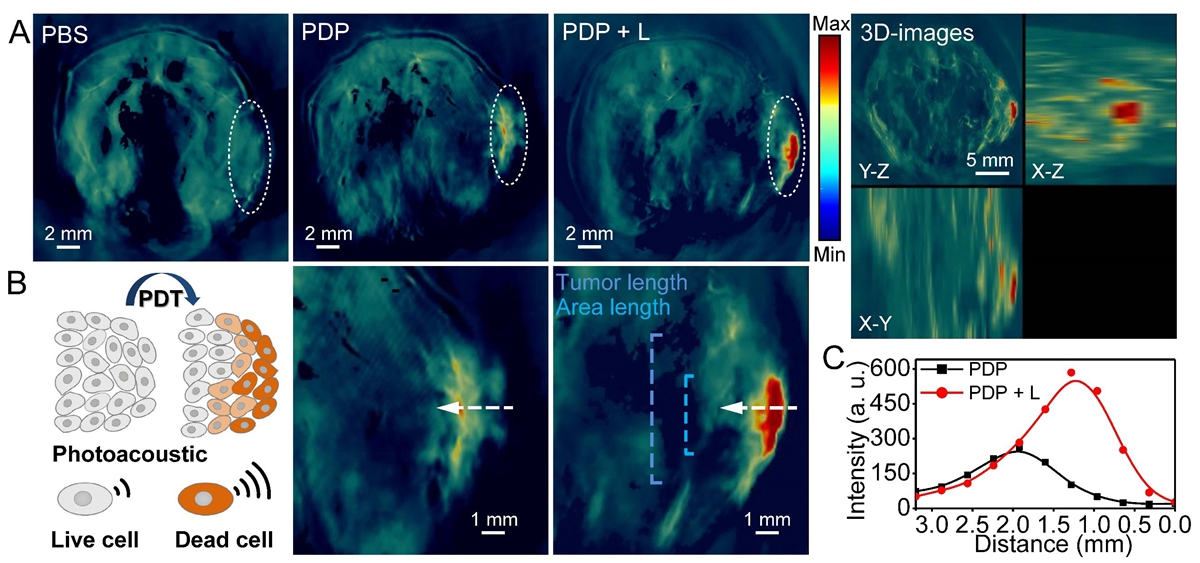
图 4. 光声评估肿瘤凋亡情况
(A)PBS、PDP 和 PDP + 光组中4T1荷瘤小鼠的光声成像图。右侧为在光照10小时后肿瘤区域的3D图像。白色圆圈代表肿瘤区域。 (B) 凋亡细胞分布示意图,右侧为肿瘤区域光声图像的放大图。 (C) 跨白色箭头线的光声强度剖面分析曲线。
相关成果对肿瘤药物研发及动态观察肿瘤治疗程具有重要参考意义,并以“Sequential assembled chimeric peptide for precise synergistic phototherapy and photoacoustic imaging of tumor apoptosis”为题,在Chemical Engineering Journal上发表。我校博士生张金和硕士生木永利为该论文共同第一作者,韩鹤友教授为该论文的通讯作者。该研究得到了“国家自然科学基金”(21778020;31750110464和 31950410755)、“广西科技重大专项”(Gui Ke AA18118046)等项目的资助。
审核人:韩鹤友
【英文摘要】
Although considerable progress has been made in nanomedicine, it is still of great significance for nanomedicine machines with natural targeting, diverse functions, maximum drug utilization, and outstanding performance. In this work, a simple small molecule chimeric peptide with the capability of sequential two-step self-assembly was developed. This chimeric peptide could be self-assembled into larger nanoparticles from smaller nanoparticles at tumor extracellular acidic microenvironment and further aggregated in apoptotic tumor cells mediated by photodynamic therapy. In addition to the nanostructure changes, the increasing of size could accelerate cell internalization and tumor accumulation of chimeric peptide for better photodynamic therapy. And the aggregation in the apoptotic cell could enhance the photothermal effect and photoacoustic signal of chimeric peptide for further photothermal therapy and photoacoustic imaging of tumor apoptosis. Both in vitro and in vivo studies demonstrated that these self-assembly behaviors endowed chimeric peptide with well tumor accumulation, preferable tumor suppression, and precise therapeutic evaluation, which should provide a new way for the construction of efficient theranostic agent based on chimeric peptides.

