南湖新闻网讯(通讯员 姚志超 张振宇)近日,我校植物科学技术学院、园艺植物生物学教育部重点实验室张宏宇教授团队研究成果以“Compartmentalized PGRP expression along the Dipteran Bactrocera dorsalis gut forms a zone of protection for symbiotic bacteria”为题在Cell Reports发表。研究从肠道区域化角度揭示了Imd免疫信号通路保持高免疫活性抵御外来病原菌的同时保护肠道有益共生菌的分子机制。
几乎所有的后生动物肠道内都栖居着大量微生物,其中肠道共生菌为宿主提供营养物质,促进营养物质消化吸收,调控宿主行为等方面发挥着重要的生理作用。但肠道作为宿主连接外部的重要交界面,其面对着来自外部环境的诸多挑战,例如病原菌入侵。因此,在这样一种复杂的环境下,昆虫肠道免疫系统如何在保护肠道有益共生菌的同时有效的清除外来微生物的作用机制尚缺乏认识。
该研究结合微生物组和转录组学发现,橘小实蝇成虫肠道内有益共生菌存在肠道区域分布现象,主要分布于中肠前段;而Imd信号通路免疫基因同样存在区域化表达现象,肽聚糖识别受体(PGRPs)家族基因肠道区域化表达与肠道共生菌区域化分布相匹配。其中PGRP-LB和PGRP-SB基因区域化表达与共生菌区域化分布成正相关,而PGPRP-LC基因及其介导的抗菌肽基因(AMPs)区域化表达与共生菌区域化分布成负相关。
作者利用RNAi技术研究发现PGRP-LB和PGRP-SB基因为橘小实蝇肠道Imd信号通路的主要负调控基因,PGRP-LB和PGRP-SB基因的沉默会诱导AMG区段AMPs基因上调表达,进而破坏了宿主肠道微生物的群落稳态平衡,肠道共生菌显著减少,次要菌群显著增加。当PGRP-LB和PGRP-SB基因的沉默效果消失后,这种紊乱的肠道微生物群落也恢复至正常水平。
在前肠高表达的PGPR-LC基因及其介导的AMPs基因在宿主免疫防御中具有重要作用。喂食橘小实蝇条件致病菌Providencia rettgeri能显著诱导前肠PGPR-LC及AMPs基因的上调表达。而前肠中PGPR-LC基因的沉默所导致的AMPs基因下调会损害Imd信号通路清除外来病原菌的能力,从而导致前肠和中肠中的P. rettgeri细菌载量显著增加,进而会破坏中肠前段肠道共生菌的稳态,导致该区段中肠道共生菌载量减少。
基于上述结论,作者提出了一个Imd免疫信号通路为肠道共生菌提供保护区的调控网络模型,即区域化表达的PGRPs基因调控Imd信号通路效应基因AMPs的肠道区域化表达,通过前肠高表达有效防御外来病原菌,在前中肠和中中肠低水平表达为肠道共生菌的稳定定殖提供“保护区”。该研究阐明了Imd信号通路如何通过肠道区域化表达而实现有效防御外来病原菌的同时耐受肠道共生微生物的分子机制,为揭示免疫系统如何维持宿主肠道微生物稳态平衡的机制。
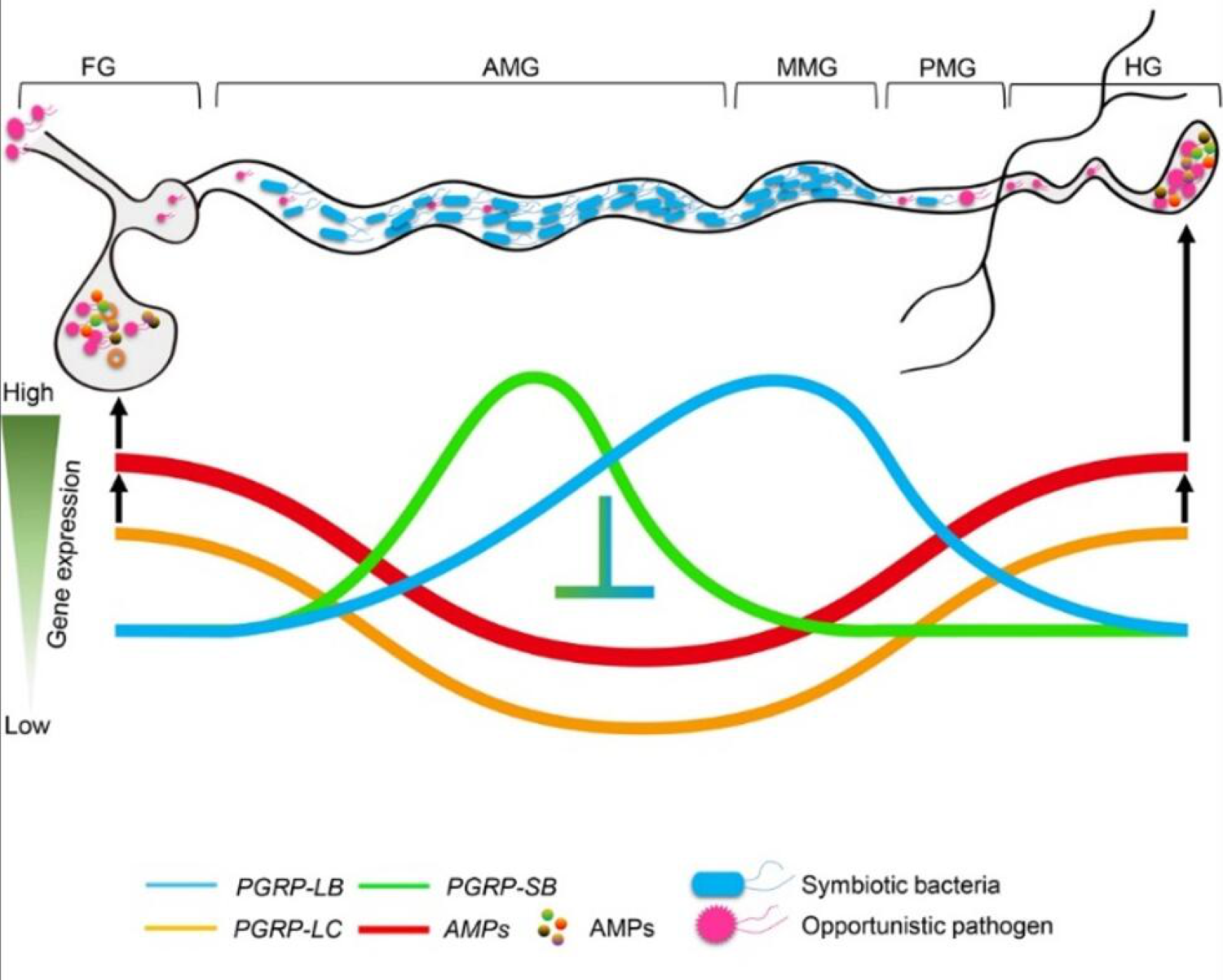
Imd通路PGPRs家族基因为肠道共生菌建立“保护区”的调控模式图
华中农业大学博士后姚志超为论文的第一作者,张宏宇教授为通讯作者,该团队已毕业博士蔡朝辉、博士生白帅和研究生马琼可、王译晨、张萍、郭琼钰、顾健,以及瑞士洛桑联邦理工学院Bruno Lemaitre教授参与部分研究工作。美国约翰·霍普金斯大学Marcelo Jacobs-Lorena教授、以色列农业研究中心Michael Ben-Yosef 博士、该团队李晓雪教授和瑞士洛桑联邦理工学院Hannah Westlake女士提供帮助。本研究得到了国家自然科学基金(Nos. 31872931, 31801744 和 31572008)和国家现代农业产业技术体系(No. CARS-26)的支持。
审核人:张宏宇
【英文摘要】
l All metazoan guts are subject to opposing pressures wherein the immune system must eliminate pathogens while tolerating the presence of symbiotic microbiota. The Imd pathway is essential to defense against invading pathogens in insect guts, but tolerance mechanisms are less understood.
l Herein, by using high throughput sequencing and qPCR, we find that symbiotic bacteria are mainly located in the anterior midgut (AMG) of Bactrocera dorsalis, and their spatial distribution in different gut regions perfectly matches the expression profiles of PGRP-LB and PGRP-SB, two PGRP genes that negatively regulate the Imd pathway of B. dorsalis. Both PGRP-LB and PGRP-SB in the midgut restrain host’s immune response to provide a protective zone for symbiotic bacteria. Consistent with this, knock-down of PGRP-LB and PGRP-SB enhances the expression of antimicrobial peptide genes and reduces Enterobacteriaceae numbers while increasing abundance of opportunistic pathogens. Microbiota numbers recover to normal levels after the RNAi effect subsided. In contrast, high expression of PGRP-LC in the foregut allows increased antibacterial peptide production to efficiently filter the entry of pathogens, silencing the Imd pathway receptor gene PGRP-LC increases colonization by the opportunistic pathogen Providencia rettgeri, which ultimately overtakes the AMG and disrupts the microbiota.
l Taken together, our study describes a mechanism by which regional expression of PGRPs construct a protective zone for symbiotic microbiota while maintaining the ability to fight pathogens.
论文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01378-X

