南湖新闻网讯(通讯员 张文君)近日, 我校资源与环境学院生物矿化课题组首次提出在水稻单细胞的细胞壁中,硅可以和半纤维素组分中的木葡聚糖共价交联形成有机硅复合物,进而改善细胞壁的力学性能和结构稳定性。相关研究成果发表在Carbohydrate Polymers上。
硅是地壳中含量第二丰富的元素,也是水稻生长的必需营养元素,能帮助水稻缓解各种非生物和生物胁迫。课题组从最初发现水稻植株中除了无机的二氧化硅外,细胞壁上还存在一种与半纤维素结合的微量有机硅(He et al., New Phytol., 2013; 2015),并对水稻抵抗重金属镉胁迫(Liu et al., New Phytol., 2013;Ma et al., New Phytol., 2015)具有重要的生物学功能。然而,细胞壁中半纤维素组分众多,硅到底与其中何种组分交联,一直是研究中的“拦路虎”,成为难以攻克的“瓶颈”问题。
为了进一步确定有机硅与半纤维素交联的组分,课题组又经过五年艰难摸索,联合借助了电感耦合等离子体质谱(ICP-MS)和X射线光电子能谱(XPS)分析了半纤维素组分中含量最高的木聚糖和木葡聚糖上硅含量和化学组成;基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)测定了木葡聚糖和木聚糖的寡糖释放量;原子力显微镜(AFM)液下成像活细胞,并借助AFM峰值力定量纳米力学成像(PF-QNM)针尖修饰的木葡聚糖-1,4-内切葡聚糖酶(XEG)和1,4-b-内切木聚糖酶与纤维素丝表面的单分子粘附力,最终确定了硅主要与半纤维素中的木葡聚糖共价结合(图1),从而增强对纤维素酶解的抗性(图2),并改善了细胞壁的纳米机械性能。该研究显著地推动了植物硅营养研究的进程,并对理解硅元素的植物营养作用具有深刻的理论意义。
该研究由国家自然科学基金(31672222 和31172027)资助,论文第一作者为博士研究生蒲军保,王荔军教授和张文君副教授为共同通讯作者。
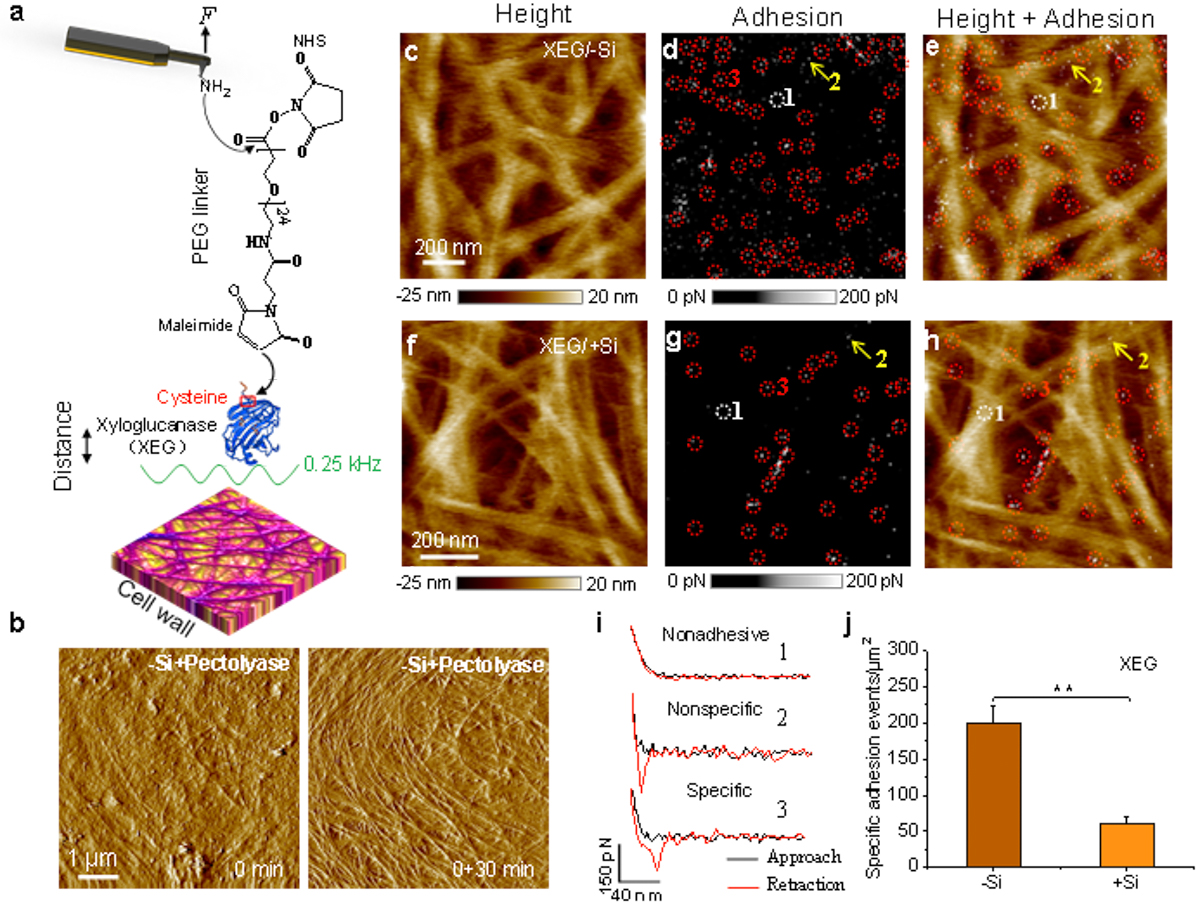
原位原子力显微镜(AFM)定量纳米力学(PF-QNM)成像细胞壁。(a) PEG交联剂通过连接半胱氨酸将木葡聚糖酶(XEG)修饰到AFM针尖上。(b)减硅细胞壁用果胶酶反应30分钟前后的原子力形貌图。去果胶后的(c-e)减硅和(f-h)加硅细胞壁的(c, f )高度图,(d, g)粘附力图和(e, h)它们的合并图像。(i) 典型的无粘附力、非专一性和专一性结合的力-距离曲线。(j) 加硅细胞壁上XEG 的结合位点显著比减硅细胞少。
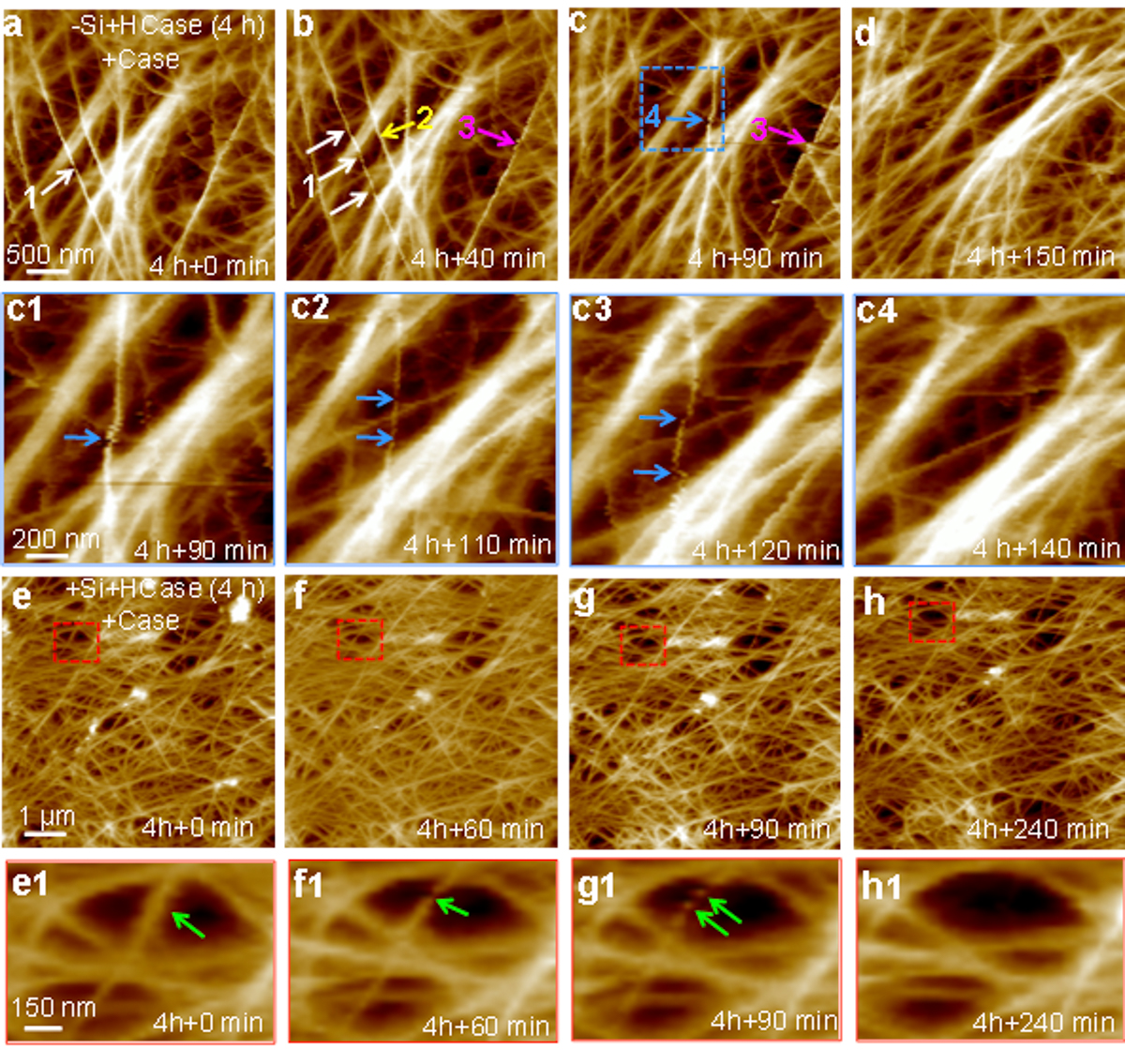
原位原子力显微镜(AFM)观察纤维素酶原位溶解细胞壁的时间动态图。(a-d)减硅细胞壁的原位溶解图及 (c1-c4)图c中蓝色虚线框中单根纤维丝放大后的酶解时间动态图。(e-h)加硅细胞壁的酶解动态图及(e1-h1)放大后单根纤维丝的酶解时间动态图。
审核人:王荔军
【英文摘要】
Plant cell walls exhibit excellent mechanical properties, which form the structural basis for sustainable bioresources and multifunctional nanocelluloses. The wall nanomechanical properties of living cells through covalent modifications of hybrid inorganic elements, such as silicon, may confer significant influence on local mechano-response and enzymatic degradation. Here, we present a combination of ex situ measurements of enzyme-released oligosaccharide fragments using MALDI-TOF MS and in situ atomic force microscopy (AFM) imaging through PeakForce quantitative nanomechanical mapping of tip-functionalized single-molecule enzyme-polysaccharide substrate recognition and the nanoscale dissolution kinetics of individual cellulose microfibrils of living rice (Oryza sativa) cells following silicate cross-linking of cell wall xyloglucan. We find that xyloglucan-bound silicon enhances the resistance to degradation by cellulase and improves the wall nanomechanical properties in the elastic modulus at the single-cell level. The findings establish a direct link between an inorganic element of silicon and the nanoscale architecture of plant cell wall materials for sustainable utilization.

