南湖新闻网讯(通讯员 卢利森)2023年1月24日,我校生命科学技术学院、生物医学与健康学院金红林教授团队的研究成果以“Engineered microparticles for treatment of murine brain metastasis by reprograming tumor microenvironment and inhibiting MAPK pathway”为题发表在Advanced science上。该研究团队利用基因工程构建了一种可跨越血脑屏障的放疗衍生微囊泡,并装载去泛素化酶USP7的抑制剂P5091,实现了对多发性肺癌脑转移的有效治疗,并显著提升了免疫治疗的应答率。
肺癌脑转移(BRM)是造成肺癌患者高死亡率的主要原因,并且90%以上的晚期肺癌患者都会发生肺癌脑转移;用于临床治疗BRM的常规手段是手术、化疗和放疗,但由于血脑屏障的存在以及大脑的复杂神经网络,限制了患者在上述治疗手段中的获益率。而BRM过于恶劣的抑制性微环境往往导致免疫治疗的响应率较低。如何有效跨越血脑屏障、规避化疗药物对正常神经细胞的损伤、放大放疗在多发性BRM患者中的适应性,以及有效调控免疫治疗是BRM治疗迫切需要解决的问题。
该团队通过组织芯片和多色荧光技术,首次提出去泛素化酶UPS7在人和小鼠的肺癌脑转移模型中同步高表达,可作为治疗该疾病的重要靶标;并且该研究比较了肿瘤不同处理方式得到的囊泡对巨噬细胞的靶向和极化作用,提出了以放疗肿瘤细胞衍生的微囊泡(RMPs)为药物载体,携载USP7抑制剂P5091治疗肺癌脑转移模型。为了有效跨血脑屏障和靶向肿瘤区域M2型巨噬细胞,该研究在放疗微囊泡(RMP)表面基因工程化展示仿高密度脂蛋白HDL的多肽R4F(P5091@RMPs-R4F),可有效促进P5091@RMPs-R4F通过SR-B1受体实现在BBB模型中的转胞吞作用,并且可同时通过SR-B1受体靶向重编程高表达CD206的M2型促肿瘤巨噬细胞。机制上,P5091@RMPs-R4F可在靶向杀伤肺癌脑转移肿瘤细胞的同时,逆转抑制性肿瘤微环境,促进促炎性细胞因子如CCL9/10、IL-1β以及TNF-α的释放,进而增强效应T细胞的浸润以及IFN-γ等细胞因子的释放;通过联合PD-1抗体,P5091@RMPs-R4F可显著增强肺癌脑转移模型小鼠的生存率,为临床治疗BRM患者提供新思路。
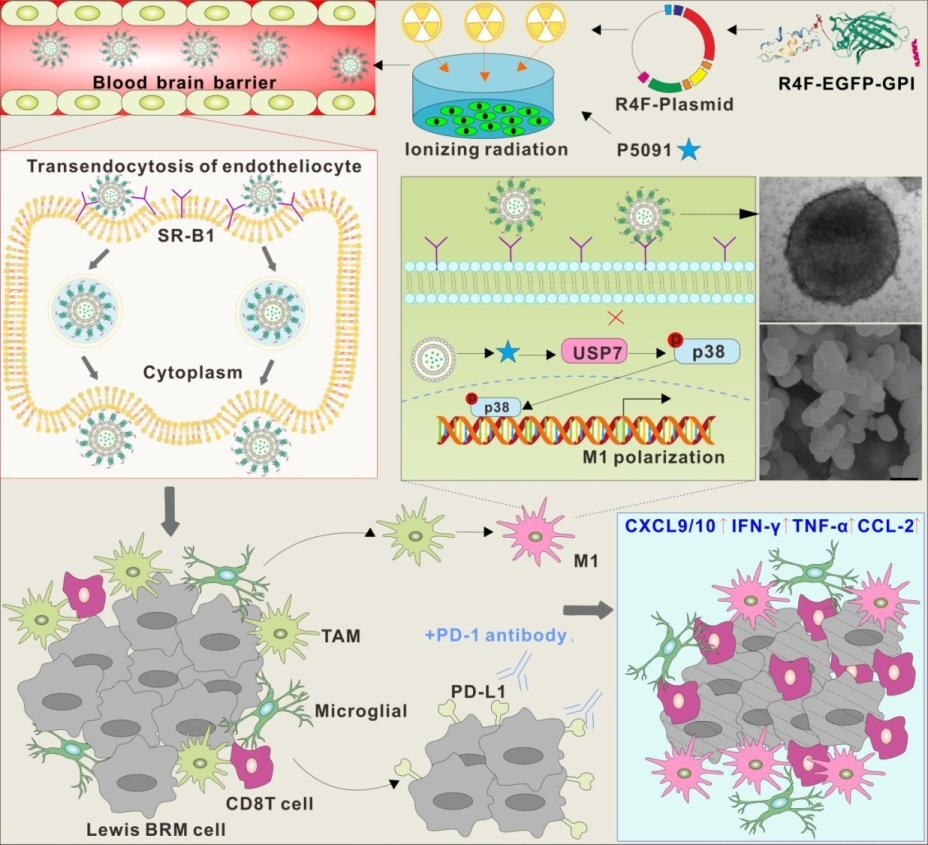
RMPs的设计和作用机制图
团队创新性的提出以USP7分子作为靶标,以放疗肿瘤细胞衍生微颗粒作为载体,以基因工程为手段在外囊泡表面展示R4F多肽,构建了可通过SR-B1受体主动跨血脑屏障和靶向以及极化M2型巨噬细胞的纳米药物P5091@RMPs-R4F,通过静脉注射该药物,可显著延缓肺癌脑转移模型的发生发展以及增强肺癌脑转移模型对免疫治疗的响应率,为临床治疗肺癌脑转移患者提供新思路。
该研究得到国家自然科学基金、湖北省重点研发计划,以及中国博士后面上项目的资助。华中农业大学生物医学与健康学院金红林教授、邓得强博士后以及华中科技大学同济医学院附属协和医院万超博士为文章的共同通讯作者,课题组博士后卢利森、首都医科大学附属北京友谊医院訾化端,以及华中科技大学同济医学院附属协和医院周洁为文章的共同第一作者。
【英文摘要】
Brain metastases (BRM) are common in advanced lung cancer. However, their treatment is challenging due to the blood-brain barrier (BBB) and the immunosuppressive tumor microenvironment (ITME). Microparticles (MPs), a type of extracellular vesicle, can serve as biocompatible drug delivery vehicles that can be further modulated with genetic engineering techniques. We compared MPs prepared from cells induced with different insults and found that radiation-treated cell–released microparticles (RMPs) achieved optimal targeting and macrophage activation. The enzyme ubiquitin-specific protease 7 (USP7), which simultaneously regulates tumor growth and reprograms M2 macrophages (M2Φ), was found to be expressed in BRM. We then constructed engineered RMPs comprising:1) the RMP carrier that targets and reprograms M2Φ; 2) a genetically expressed SR-B1-targeting peptide for improved BBB permeability; and 3) a USP7 inhibitor to kill tumor cells and reprogramM2Φ. These RMPs successfully crossed the BBB and targeted M2Φin vitro and in vivo in mice, effectively reprogramming M2Φ and improving survival in a murine BRM model. Therapeutic effects were further augmented when combined with immune checkpoint blockade. This study provides proof-of-concept for the use of genetically engineered MPs for the treatment of BRM.
论文链接:https://doi.org/10.1002/advs.202206212
审核:金红林
