南湖新闻网讯(通讯员 于晓)近日,我校农业微生物资源发掘与利用全国重点实验固定研究员、湖北洪山实验室于晓教授,德州农工大学生物化学与生物物理系的何平教授和单立波教授团队在Cell(《细胞》)杂志上在线发表了题为“A phospho-switch constrains BTL2-mediated phytocytokine signaling in plant immunity”的研究论文。该研究首次发现PRR蛋白能够保护受损PTI免疫反应的新机制,建立了植物PTI-DTI-ETI不同免疫途径信号交互的新模式。

植物依赖于细胞膜表面的模式识别受体(pattern-recognition receptors, PRRs)识别微生物相关分子模式(MAMPs)或植物自身损伤相关因子(DAMPs),从而激活PTI或DTI免疫反应。胞内的NLR(nucleotide-binding, leucine-rich repeat receptors)受体直接或间接识别病原分泌的效应蛋白(effector),触发ETI免疫反应。植物类受体蛋白激酶BAK1作为共受体,与多种免疫相关PRR形成受体复合物激活PTI,而病原细菌和真菌的多种效应蛋白攻击BAK1以抑制植物PTI。BAK1及其同源蛋白BAK1-LIKE 1(BKK1)/SERK4的双突变体表现出自我免疫和细胞死亡,这表明植物中存在特定机制监控BAK1蛋白的稳态,在感知BAK1受损后启动强烈免疫以补偿受损的PTI。BAK1/SERK4的缺失或受损如何被感知,该自我免疫途径如何被触发激活仍然未知,植物免疫补偿的信号通路和分子机制均有待解析。
该研究通过基于病毒诱导基因沉默的高通量筛选体系,筛选了一系列类受体激酶(RLK)的T-DNA插入突变体,成功鉴定到LRR-RLK BAK TO LIFE 2 (BTL2)的突变体可以完全抑制沉默BAK1/SERK4引起的细胞死亡,同时超表达BTL2诱导植物出现细胞死亡表型,该细胞死亡诱导能力依赖于BTL2的激酶活性。进一步探究BAK1对BTL2的调控机制发现,BAK1直接与BTL2互作,通过磷酸化BTL2第676位点丝氨酸残基进而抑制BTL2的蛋白活性,以维持正常生长的植物稳态。
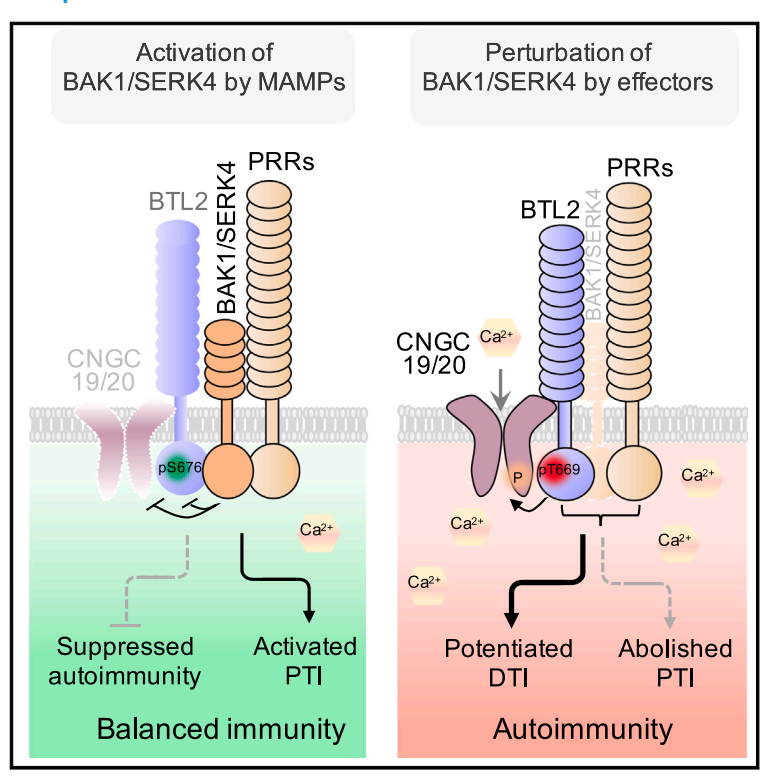
BTL2与该团队前期报道的钙离子通道蛋白CNGC20相互作用,并且介导CNGC20的N端调控区磷酸化;电生理学实验表明BTL2可直接激活CNGC20的钙离子通道活性。病原菌接种实验表明BTL2并不直接调控对多种病原菌的抗病性和植物的PTI/ETI免疫反应,但是BTL2与植物DAMP分子或(免疫相关细胞因子)PEPs的受体PEPR1/2和SCOOPs的受体MIK2相互作用,在BAK1及其同源蛋白缺失状态下,导致多个植物DTI免疫途径的过度激活,进而通过EDS1-PAD4-ADR1信号模块诱导强烈的免疫反应导致细胞死亡,从而补偿受损的PTI免疫反应。
综上,该研究解决了长期未知的由BAK1/SERK4缺陷引起自我免疫的相关机制,阐明了植物DTI免疫途径对PTI免疫受损的新型保护机制,拓展了对植物多层次免疫反应相互关系的认知的理解,为利用植物先天免疫提高植物抗病性提供了新的视角。
我校微生物资源发掘与利用全国重点实验固定研究员、湖北洪山实验室于晓教授为该论文的第一作者,德州农工大学生物化学与生物物理系的何平教授和单立波教授为该论文的共同通讯作者。华中农业大学植物科学技术学院李博教授和生命科学技术学院薛绍武教授参与了本项研究。
英文摘要:
Enabling and constraining immune activation is of fundamental importance in maintaining cellular homeostasis. Depleting BAK1 and SERK4, the co-receptors of multiple pattern recognition receptors (PRRs), abolishes pattern-triggered immunity but triggers intracellular NOD-like receptor (NLR)-mediated autoimmunity with an elusive mechanism. By deploying RNAi-based genetic screens in Arabidopsis, we identified BAK-TO-LIFE 2 (BTL2), an uncharacterized receptor kinase, sensing BAK1/SERK4 integrity. BTL2 induces autoimmunity through activating Ca2+ channel CNGC20 in a kinase-dependent manner when BAK1/SERK4 are perturbed. To compensate for BAK1 deficiency, BTL2 complexes with multiple phytocytokine receptors, leading to potent phytocytokine responses mediated by helper NLR ADR1 family immune receptors, suggesting phytocytokine signaling as a molecular link connecting PRR- and NLR-mediated immunity. Remarkably, BAK1 constrains BTL2 activation via specific phosphorylation to maintain cellular integrity. Thus, BTL2 serves as a surveillance rheostat sensing the perturbation of BAK1/SERK4 immune co-receptors in promoting NLR-mediated phytocytokine signaling to ensure plant immunity。
论文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00423-3
审核人:李博
