南湖新闻网讯(通讯员 包伟怡) 精确的DNA复制是细胞增殖的基础。然而,DNA复制会受到各种因素(例如DNA损伤、dNTP缺乏等)的干扰,导致DNA复制胁迫,从而威胁基因组稳定性。为了应对这些挑战,细胞会激活复制胁迫应答机制,包括诱导细胞周期停滞、稳定复制叉、增加dNTP的合成等。
进化上高度保守的蛋白激酶ATR是真核生物应答复制胁迫的核心调控蛋白之一。但是植物ATR调控复制胁迫应答的机制还不太清楚。在前期的研究中,华中农业大学严顺平/王利利团队发现植物ATR通过下游蛋白激酶WEE1来抑制E3泛素连接酶FBL17 (SOAT1)、多效调节蛋白PRL1 (SOAT2)和翻译抑制因子GCN20 (SOAT3)来暂停细胞周期进程。
dNTPs是DNA复制和DNA修复的原料。核糖核苷酸还原酶(RNR)是催化dNTP合成的限速酶。在动物和酵母中的研究发现RNR在转录和转录后水平受到精准调控。拟南芥RNR由1个大亚基(RNR1) 和3个小亚基(TSO2,RNR2A,RNRN2B)组成,其中TSO2起主要作用。TSO2的突变会导致植物生长和DNA修复的缺陷。目前,植物调控RNR的机制尚不清楚。

Cell reports发表研究论文
6月23日,严顺平/王利利团队在国际著名期刊Cell Reports发表了题为“Protein kinase ATR inhibits E3 ubiquitin ligase CRL4PRL1 to stabilize ribonucleotide reductase in response to replication stress”的研究论文,发现ATR除了诱导细胞周期停滞之外,还可以通过增强dNTP合成来调控复制胁迫应答。
在该研究中,作者通过激活标签法筛选拟南芥atr突变体的抑制子(soat),发现soat4可以部分抑制atr突变体对复制胁迫的超敏感性。进一步研究发现,soat4的表型是TSO2表达量增加引起的;TSO2与PRL1相互作用;PRL1通过Cullin4介导的E3泛素连接酶CRL4PRL1多聚泛素化TSO2,促进TSO2通过26S蛋白酶体途径被降解。结合之前的研究, 作者认为ATR-WEE1通过负调控CRL4PRL1提高了TSO2的蛋白稳定性,从而促进dNTP的合成。综上所述,本研究发现了植物调控复制胁迫应答的新模块ATR-PRL1-RNR,揭示了植物RNR蛋白在翻译后水平被调控的机制。鉴于这些蛋白在真核生物中的高度保守性,ATR-PRL1-RNR调控模块也可能在其他真核生物中发挥作用。
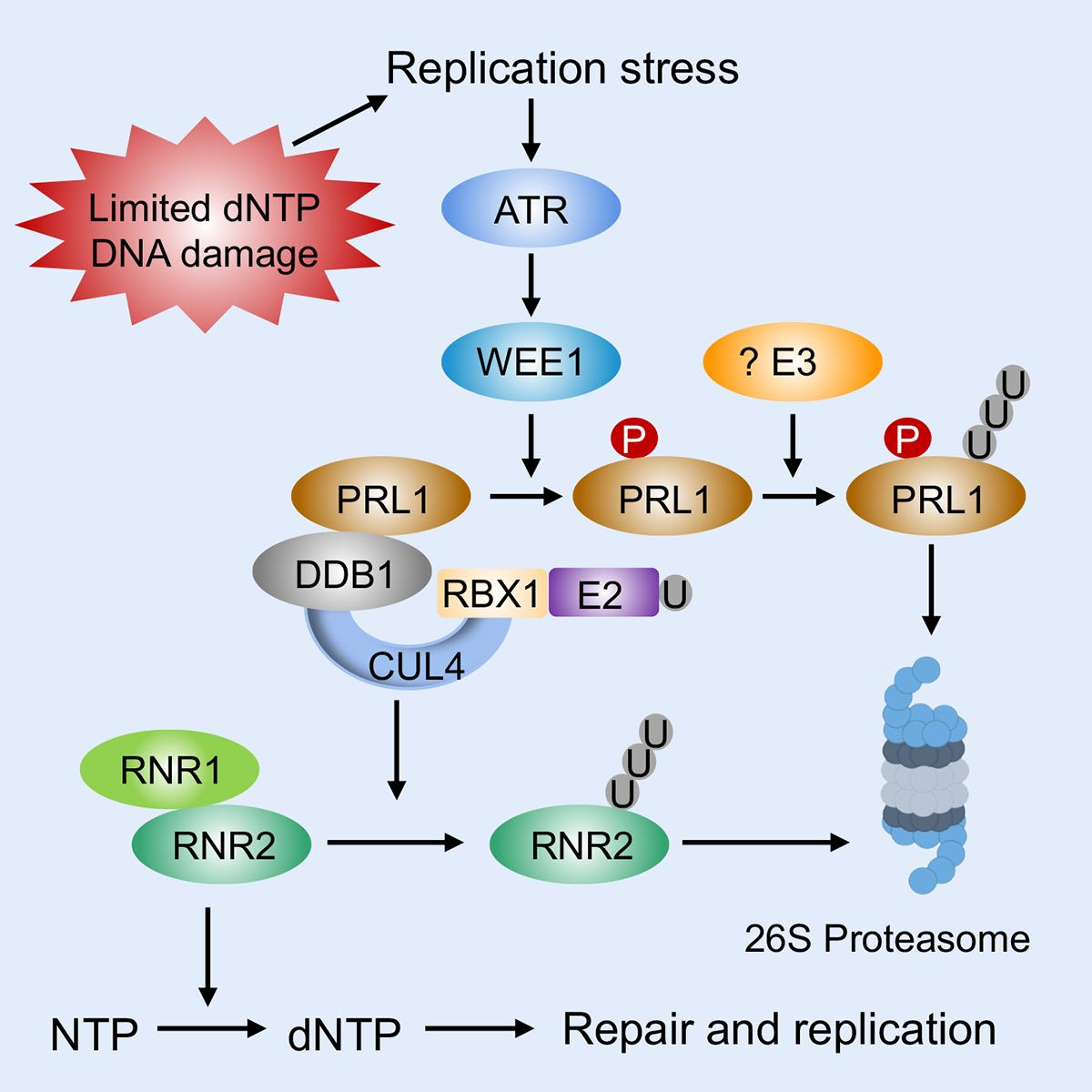
ATR-PRL1-RNR工作模型
该团队的博士研究生包伟怡为论文的第一作者,严顺平教授和王利利研究员为共同通讯作者。该研究得到了国家自然科学基金、华中农业大学-中国农业科学院深圳农业基因组研究所合作基金等项目的资助。
【英文摘要】
The protein kinase ATR is essential for replication stress responses in all eukaryotes. Ribonucleotide reductase (RNR) catalyzes the formation of deoxyribonucleotide (dNTP), the universal building block for DNA replication and repair. However, the relationship between ATR and RNR is not well understood. Here, we show that ATR promotes the protein stability of RNR in Arabidopsis. Through an activation tagging-based genetic screen, we found that overexpression of TSO2, a small subunit of RNR, partially suppresses the hypersensitivity of theatrmutant to replication stress. Biochemically, TSO2 interacts with PRL1, a central subunit of the Cullin4-based E3 ubiquitin ligase CRL4PRL1, which polyubiquitinates TSO2 and promotes its degradation. ATR inhibits CRL4PRL1to attenuate TSO2 degradation. Our work provides an important insight into the replication stress responses and a post-translational regulatory mechanism for RNR. Given the evolutionary conservation of the proteins involved, the ATR-PRL1-RNR module may act across eukaryotes.
论文链接:
https://doi.org/10.1016/j.celrep.2023.112685
审核:严顺平
