南湖新闻网讯(通讯员 王玲)2023年7月4日,我校生命科学技术学院、生物医学与健康学院精准营养与代谢团队陈振夏课题组在国际学术期刊Advanced Science在线发表题为“Male-Biased Gut Microbiome and Metabolites Aggravate Colorectal Cancer Development”的论文。
结直肠癌(CRC)是世界第三大常见癌症,也是具有性别二态性的癌症之一,其发病率、死亡率及发病部位都具有一定的性别差异。研究表明,肠道微生态紊乱是结直肠癌发生发展的关键环境因素,肠道菌群失调可引起结直肠癌的发生与发展。在 CRC 患者中,机会性病原体(如具核梭杆菌、牛链球菌、鸡链球菌、大肠杆菌和脆弱拟杆菌等)的丰度增加。同时,性别又是导致肠道微生物差异的主要原因之一,因此,肠道微生物的性别差异可能与结直肠癌的性别二态性存在潜在的联系,但关于性别偏好性的肠道微生物与CRC性别差异的研究鲜有报道。
华中农业大学生物医学与健康学院陈振夏教授实验室长期致力于两性表型差异以及性别偏好基因功能研究,擅长将多组学分析与实验生物学验证结合。该研究团队利用多种小鼠结直肠癌模型探究性别特异性肠道微生物及其代谢变化与CRC表型性别差异的关系。研究人员首先从结直肠癌模型小鼠性别表型入手,发现结直肠癌的性别二态性在结直肠癌模型小鼠同样存在,CRC雄性小鼠的肿瘤数目和体积显著高于雌性小鼠,雄性小鼠肠道屏障功能损伤更为严重。接着通过分析雌雄小鼠粪便宏基因组和代谢组数据进一步证实了CRC小鼠存在性别差异的肠道微生物和代谢物,并通过区分性别移植CRC雌雄小鼠以及男性和女性CRC患者粪菌至伪无菌小鼠,证实了性别差异的肠道微生物和代谢物是导致结直肠癌性别差异的潜在原因之一。通过代谢物溯源分析,最后聚焦到与微生物相关且能加速男性(雄性)结肠癌发展的甘油磷脂代谢途径。
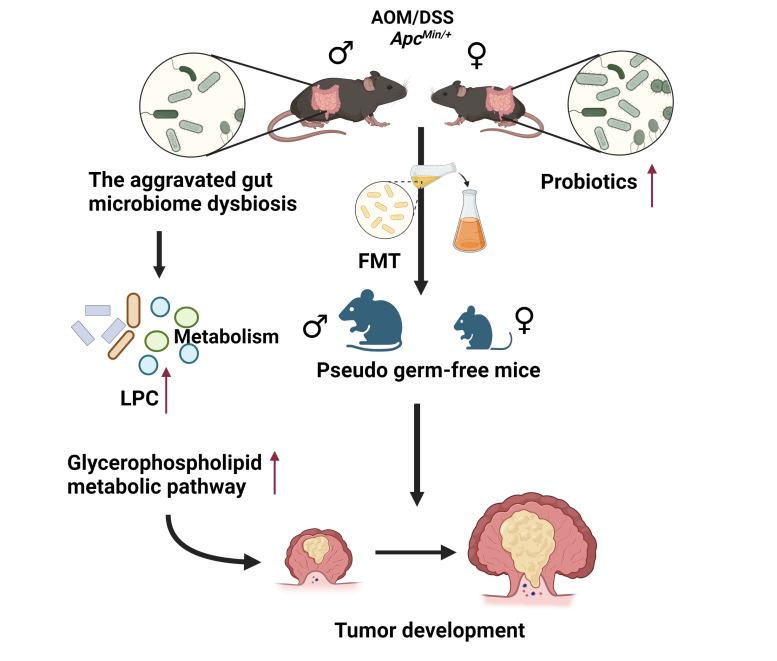
图1 性别差异的肠道微生物及代谢物是结直肠癌性别二态性的主要原因之一
华中农业大学生物医药与健康学院王玲博士后与涂懿璇博士生为该文并列第一作者,陈振夏教授与湖北省肿瘤医院梁新军教授为该文的通讯作者。本研究得到了湖北省科技重大专项、湖北省洪山实验室基金、湖北省肿瘤医院生物医学中心合作基金、湖北省卫生健康委员会科研项目等资助。
【英文摘要】
Men demonstrate higher incidence and mortality rates of colorectal cancer (CRC) than women. This study aims to explain the potential causes of such sexual dimorphism in CRC from the perspective of sex-biased gut microbiota and metabolites. The results show that sexual dimorphism in colorectal tumorigenesis is observed in both ApcMin/+ mice and azoxymethane (AOM)/dextran sulfate sodium (DSS)-treated mice with male mice have significantly larger and more tumors, accompanied by more impaired gut barrier function. Moreover, pseudo-germ mice receiving fecal samples from male mice or patients show more severe intestinal barrier damage and higher level of inflammation. A significant change in gut microbiota composition is found with increased pathogenic bacteria Akkermansia muciniphila and deplets probiotic Parabacteroides goldsteinii in both male mice and pseudo-germ mice receiving fecal sample from male mice. Sex-biased gut metabolites in pseudo-germ mice receiving fecal sample from CRC patients or CRC mice contribute to sex dimorphism in CRC tumorigenesis through glycerophospholipids metabolism pathway. Sexual dimorphism in tumorigenesis of CRC mouse models. In conclusion, the sex-biased gut microbiome and metabolites contribute to sexual dimorphism in CRC. Modulating sex-biased gut microbiota and metabolites could be a potential sex-targeting therapeutic strategy of CRC.
论文链接:https://doi.org/10.1002/advs.202206238
审核:陈振夏
