
南湖新闻网讯(通讯员 马召玉)近日,我校韩鹤友教授带领的纳米化学生物学团队在精准肿瘤治疗研究方面获重要进展,团队于iScience期刊上发表了题目为“Intracellular Ca2+Cascade Guided by NIR-II Photothermal Switch for Specific Tumor Therapy”的研究论文。博士研究生马召玉为第一作者,韩鹤友教授为通讯作者。
虽然目前出现了许多先进技术,但化疗仍然是转移性肿瘤或肿瘤不可切除病变情况的首选治疗方案。传统化疗的药物毒性经常导致患者出现恶心、呕吐、腹泻、肾脏问题和神经病理性疼痛等多种症状,严重影响患者的生活质量。因此,被巧妙设计成靶向肿瘤部位的智能型化疗药物载体应运而生,但最近的研究表明,这些药物仅有极少的药剂量被有效地输送到肿瘤部位,而剩余的大量药物则残留并扩散到了其它重要器官中,造成毒副作用或伴随诱发其它疾病。
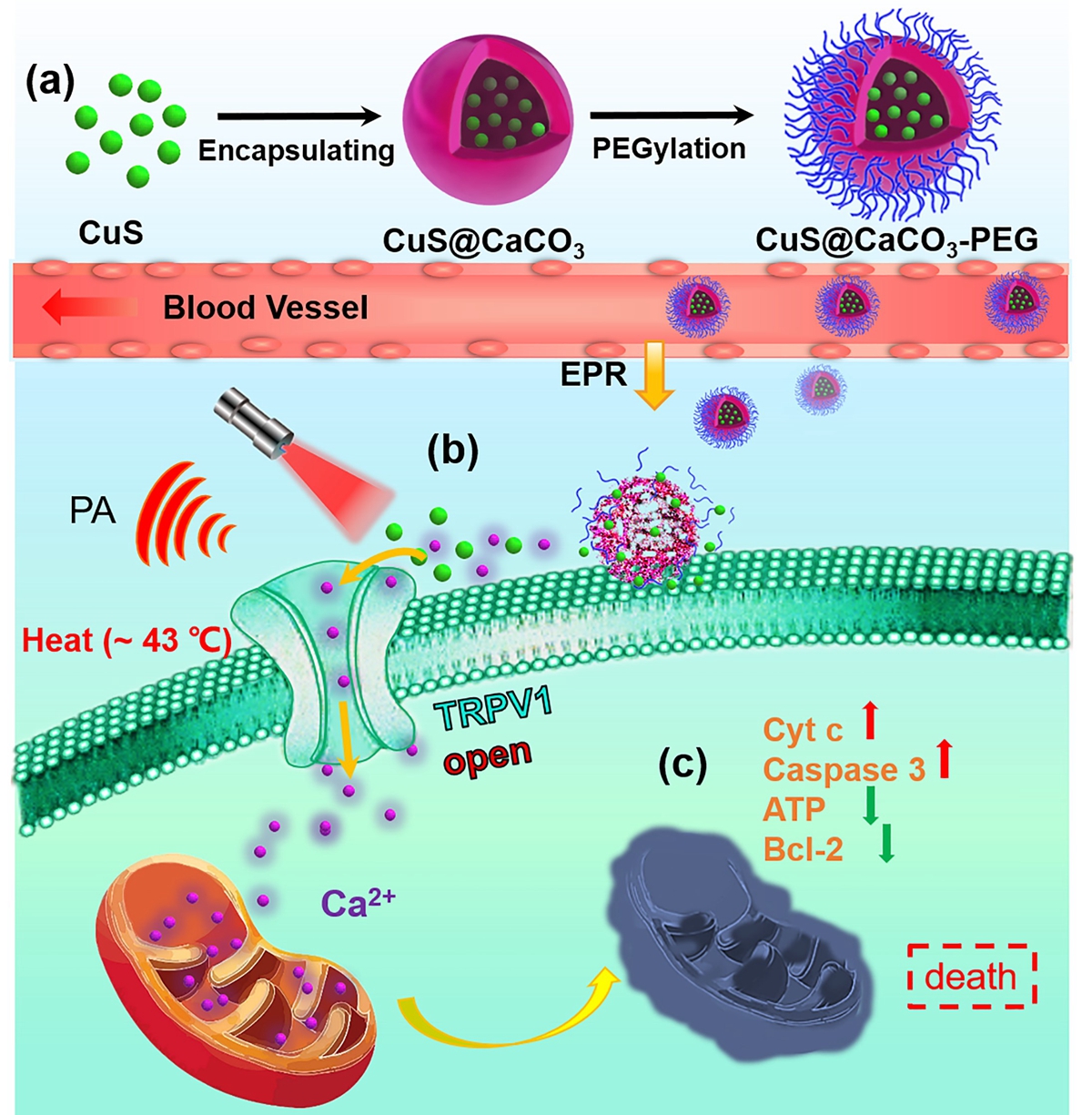
基于此,韩鹤友教授课题组巧妙地设计了体内光热激活TRPV1通道的Ca2+“瀑布”纳米治疗平台,为肿瘤精准治疗提供了新的策略。团队首先制备了“核”CuS纳米粒子,接着为其表面包被一层生物相容性良好的CaCO纳米“壳”,生成“核壳型”CuS@CaCO3纳米颗粒,最后在CuS@CaCO3表面修饰一层磷脂,形成CuS@CaCO3-PEG纳米治疗系统。其中纳米CuS具有光热转换特性,是构建Ca2+“瀑布”的“开关”,且CuS可增强三维光声成像效果并为肿瘤治疗提供即时诊断的依据。这个治疗体系最突出的优点是不引入化疗药物,因此不用担心化疗带来的毒副作用。
TRPV1是一个非选择性的阳离子通道,对Ca2+优先通过,可被热、低pH和辣椒素等外部条件激活后打开。该通道被打开后,大量的钙离子穿过细胞膜进入细胞(钙离子过超载),CuS@CaCO3-PEG纳米系统通过EPR效应被动积累在肿瘤部位,肿瘤的微酸环境导致酸响应的纳米碳酸钙分解,产生大量的钙离子并释放装载的纳米CuS;随后近红外光在肿瘤部位照射刺激CuS迅速产生大量的热,从而激活癌细胞表面的TRPV1离子通道,诱使大量的钙离子内流进入癌细胞。
线粒体是细胞的能量工厂,同时也是细胞内钙离子平衡的调节器,它是关乎细胞生存的一种亚细胞器。研究发现,钙离子浓度远远超过其调节能力(钙离子过超载)会导致线粒体功能紊乱、细胞内线粒体膜电势受损、ATP能量产生受阻和各种调节蛋白异常(Caspase-3、Cyt c上调;Bcl-2下调等),最终使得癌细胞凋亡。
本研究提出的Ca2+“瀑布”治疗模式能够同时在肿瘤微酸环境和TRPV1通道过表达的条件下被激活,有助于肿瘤的精确治疗,且不受限于肿瘤的乏氧环境;整个治疗体系没有携带抗癌药物,不用担心治疗带来的系统毒性;由于Ca2+固有的独特生物学效应,正常细胞比肿瘤细胞更能耐受其破坏性影响;在体内释放的光热CuS纳米颗粒还可增强肿瘤的三维光声成像,为肿瘤治疗提供即时诊断的依据。这种钙离子“瀑布”治疗策略有望与其他临床治疗相结合,提高肿瘤治疗效果,降低治疗带来的全身性副作用。
上述研究成果得到国家自然科学基金及校自主创新项目的资助。
审核人:韩鹤友
论文链接:https://www.sciencedirect.com/science/article/pii/S2589004220302340

