南湖新闻网讯(通讯员 董克)近日,国际学术期刊Redox Biology以 “Defective mitochondrial ISCs biogenesis switches on IRP1 to fine tune selective mitophagy”为题在线发表了我校微量元素营养生理生化团队的最新研究成果,揭示了哺乳动物细胞铁代谢与线粒体稳态的重要关系,为进一步阐明铁稳态失衡相关疾病的病理机制指明了方向。
铁是重要的微量元素,参与了电子传递及氧化磷酸化、氧气运输与呼吸作用、DNA复制转录及损伤修复等重要的生物学过程。细胞内过量的铁可通过介导Fenton反应催化脂质过氧化,诱导细胞氧化损伤,并与多种人类疾病的发生发展紧密相关。因此,细胞内铁稳态及铁代谢受到多种机制的精确调控,早期研究表明铁缺乏可损伤线粒体,重构细胞代谢模式,但其分子机制仍不清楚。
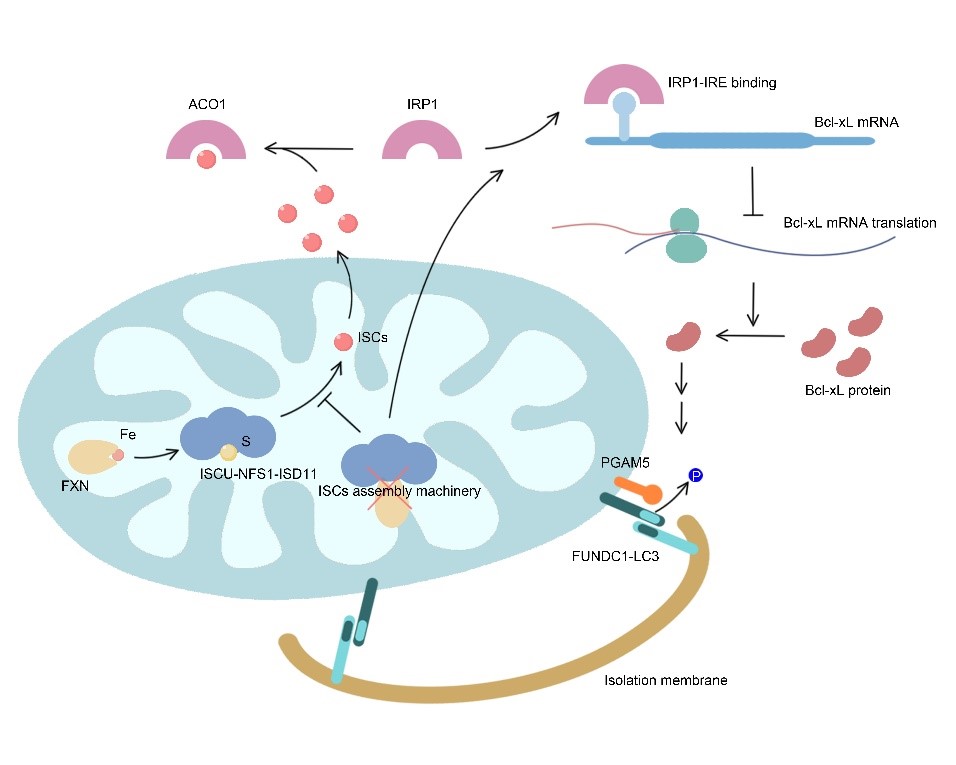
铁/铁硫簇-IRP1-Bcl-xL-FUNDC1轴调节铁缺乏诱导的线粒体自噬
在本研究中,利用铁螯合剂处理诱导细胞铁匮乏,研究发现铁缺乏可激活自噬体-溶酶体途径依赖的线粒体降解(即线粒体自噬),且该线粒体自噬高度依赖于线粒体自噬受体分子FUNDC1,敲低FUNDC1显著抑制该线粒体自噬的发生。线粒体是细胞铁代谢的中心,胞质中铁被转运至线粒体基质用以合成血红素及铁硫簇,该二者是多种代谢紧密相关蛋白的活性中心。
通过siRNA筛选实验,研究发现铁硫簇合成异常亦可诱导FUNDC1依赖的线粒体自噬,表明铁硫簇合成异常是铁缺乏诱导线粒体自噬的重要原因。细胞铁代谢及铁硫簇水平主要受铁调节蛋白IRP1的调控,当细胞铁缺乏或铁硫簇合成异常时,没有足够的铁硫簇与IRP1结合,导致IRP1游离并结合到一类含有IRE(铁调节元件)的mRNA上,调节这些靶mRNA的翻译或稳定性,调控相应蛋白的表达,继而维持细胞铁稳态并调控铁代谢。研究发现铁缺乏及铁硫簇合成异常诱导的线粒体自噬同样受IRP1的调节,敲低IRP1显著抑制该线粒体自噬的水平。通过生物信息学分析,研究团队发现FUNDC1介导的线粒体自噬的关键调控蛋白Bcl-xL的mRNA上含有一个典型的IRE序列,IRP1通过结合该IRE抑制Bcl-xL的翻译。
该研究因而鉴定出铁/铁硫簇-IRP1-Bcl-xL-FUNDC1轴在线粒体自噬及线粒体稳态中的核心调节作用,同时本研究首次发现铁硫簇是线粒体自噬及线粒体质量控制的关键内源性调节因子,该研究结果对于进一步认识铁稳态失衡相关疾病的病理机制具有重要的指导意义。
我校动科动医学院吴浩研究员、郑州大学魏慧芳博士为论文共同第一作者,吴浩、中国科学院动物研究所刘垒研究员、南开大学生命科学学院陈佺教授为论文共同通讯作者,中国科学院生物物理研究所秦燕研究员、张德玖副研究员参与并指导了本研究工作。研究得到了国家自然科学基金等项目的资助。
审核人:吴浩
论文链接:https://www.sciencedirect.com/science/article/pii/S2213231720308661?via%3Dihub

