南湖新闻网讯(通讯员 臧婧泽)2月15日,我校王鹏蔚教授课题组研究揭示了一种新的植物细胞骨架复合体NET3C-KLCR-IQD与其调控细胞骨架和内质网-质膜互作的分子机制。相关成果发表在Current Biology上。
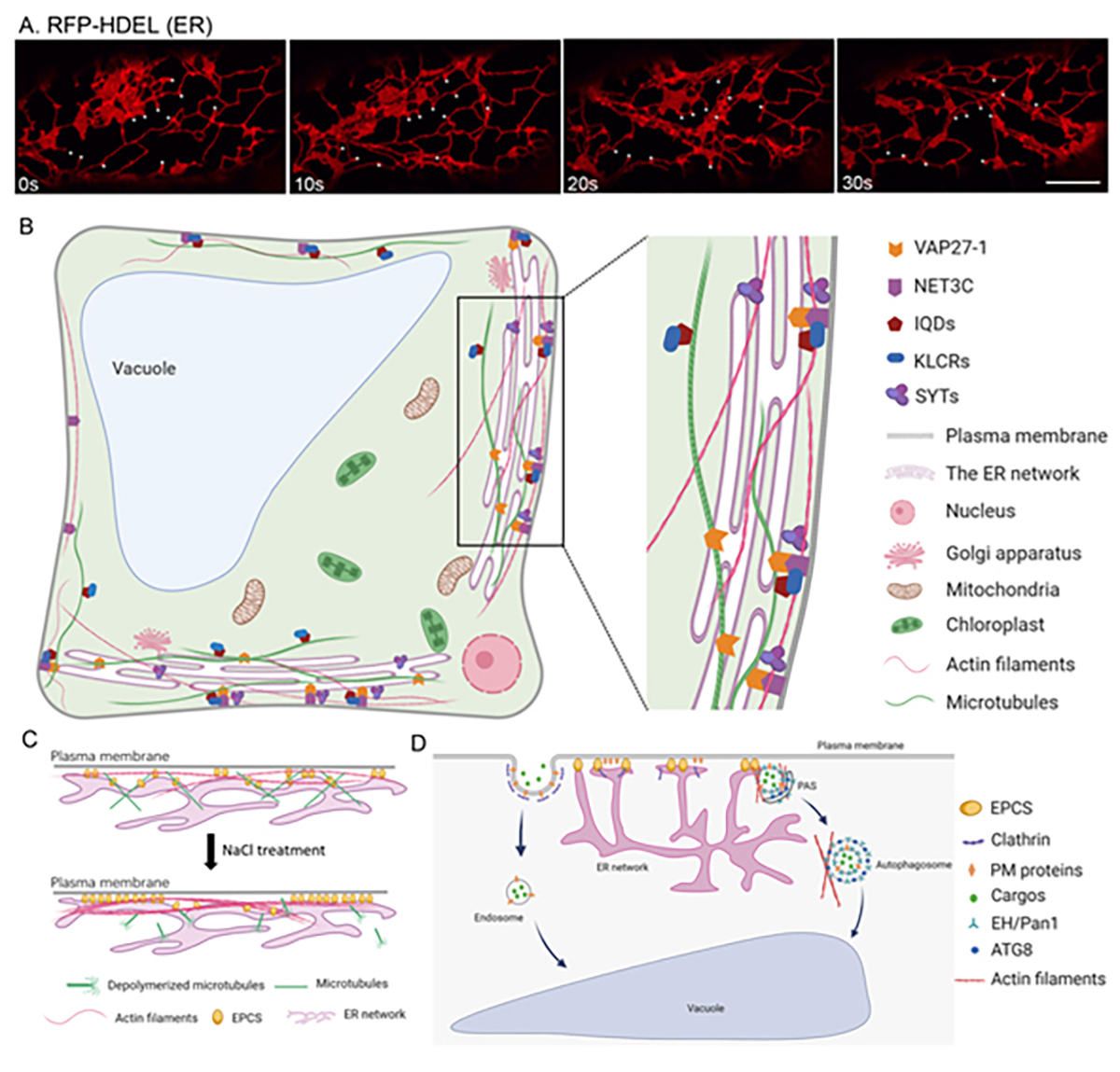 植物NET3C-KLCR-IQD复合体与内质网-质膜互作网络的生物学功能汇总
植物NET3C-KLCR-IQD复合体与内质网-质膜互作网络的生物学功能汇总
在细胞生物领域,除了对单个细胞器的功能研究之外,发现并阐明细胞器互作机制及其功能,也可以帮助我们系统地了解细胞生命活动。上世纪80年代,有学者利用透射电镜揭示了植物内质网与质膜的相互作用,但在植物细胞中此类互作的形成机制、分子构成在很长时间内都没有被解释,其生物学功能研究也无法有效开展,此问题困扰了学界多年。王鹏蔚教授与其合作者在论文中首次阐明了植物内质网-质膜互作位点(ER-PM Contact Sites, EPCSs)的分子组成 (Wang et al., 2014 Curr Biol, 24, 1397-1405),即其通过位于内质网膜上的VAP27蛋白与位于细胞质膜上的微丝结合蛋白NET3C互作,组成蛋白质复合体,而VAP27也可以通过一些横跨细胞质膜的蛋白,间接与细胞壁相连。在后续工作中,针对植物EPCSs的生物学功能,王鹏蔚教授团队展开了多方面的研究,阐明了EPCS调控细胞极性、自噬体形成的分子机制 (图1;Wang et al., 2016 New Phyt, 210:1311-1326; Wang et al., 2019 Nature Comm, 10, 5132) 。
本研究就植物EPCS与细胞骨架互作的分子机制进行了进一步的解析,发现了一个高等植物特有的蛋白复合体,即VAP27-IQD-NET-KLCR complex,其包含有植物特有的微丝结合蛋白NETWORKED protein (NET3C)、植物特有的微管结合蛋白IQ67-Domain protein (IQD)和微管马达蛋白Kinesin-light Chain Related protein (KLCR) 。此复合体可以同时与微丝-微管互作,并与内质网-质膜-细胞壁连续体结合,形成了一个横跨细胞内外的细胞骨架调控中枢,对细胞骨架与内质网结构的维持,细胞形态的建立都起到了至关重要的作用。 此研究对植物细胞骨架动态调控与细胞形态建立的机制有了更深入的解析,揭示内质网与细胞骨架在结构和功能上均存在着相互调控的机制(Zang et al., 2021 Curr Biol, 2021)。
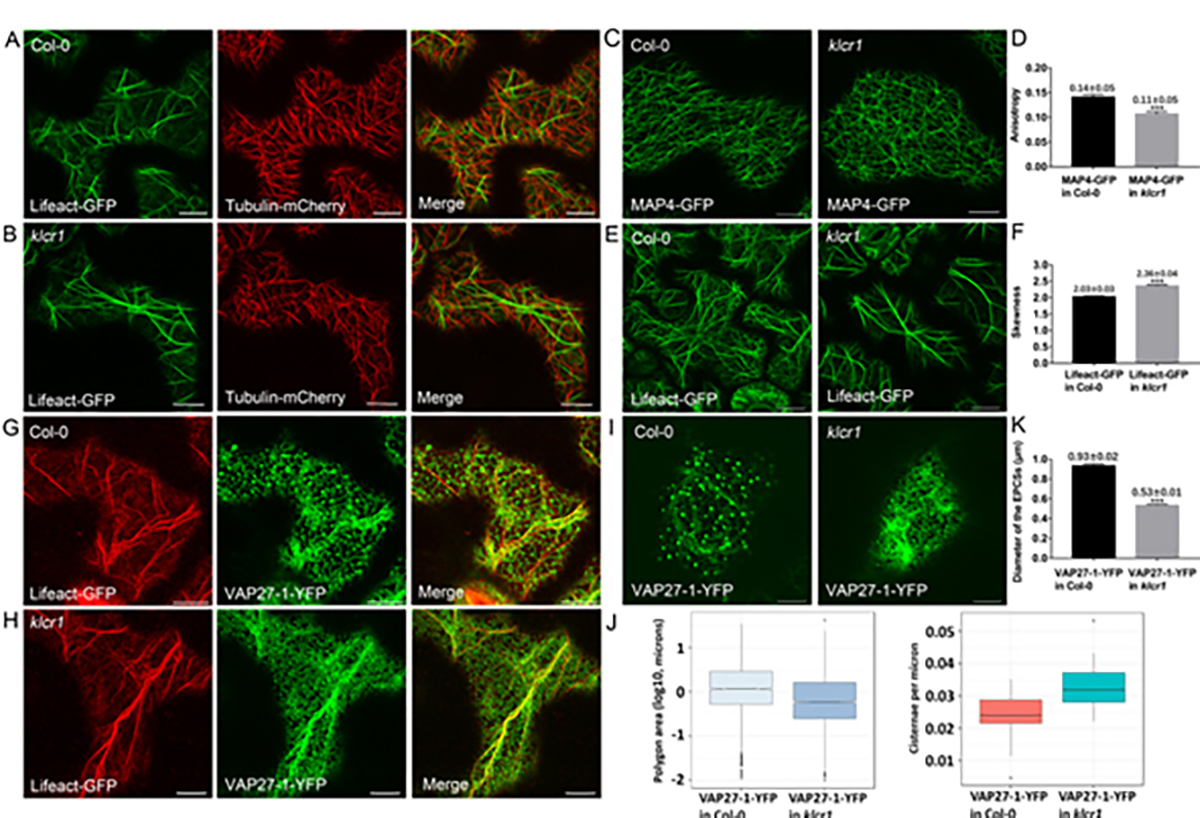 KLCR1、NET3C和IQD2功能缺失突变体的叶片表皮细胞形态与细胞骨架排列发生缺陷
KLCR1、NET3C和IQD2功能缺失突变体的叶片表皮细胞形态与细胞骨架排列发生缺陷
此外,IQD作为高等植物中特有的微管结合蛋白,功能与植物器官形态联系十分密切。除拟南芥以外,IQD编码的基因也一个保守的遗传位点,在番茄、黄瓜、水稻等作物中直接影响果实或种子的形态,调控重要的园艺或农艺性状。因此,研究内质网-质膜互作复合体的分子构成与时空表达模式,对了解植物细胞与重要器官的形态建立有着重要科学意义与潜在的应用价值。
该论文第一作者分别为我校博士研究生生臧婧泽、德国莱布尼茨植物生化研究所的博士研究生Sandra Klemm;我校王鹏蔚教授与英国杜伦大学生物系Patrick Hussey教授为共同通讯作者。莱布尼茨植物生化研究所的Katharina Burstenbinder研究员与英国牛津布鲁克斯大学的Verena Kriechbaumer博士参与了此项研究。项目得到了自然科学基金委“细胞器互作重大研究计划”、“华中农业大学自主科技创新基金”等的资助。
审核人:王鹏蔚
【英文摘要】
In plants, the cortical endoplasmic reticulum (ER) network is connected to the plasma membrane (PM) through the ER-PM contact sites (EPCSs), whose structures are maintained by EPCS resident proteins and the cytoskeleton.1, 2, 3, 4, 5, 6, 7 Strong co-alignment between EPCSs and the cytoskeleton is observed in plants,1,8 but little is known of how the cytoskeleton is maintained and regulated at the EPCS. Here, we have used a yeast-two-hybrid screen and subsequent in vivo interaction studies in plants by fluorescence resonance energy transfer (FRET)-fluorescence lifetime imaging microscopy (FLIM) analysis to identify two microtubule binding proteins, KLCR1 (kinesin-light-chain-related protein 1) and IQD2 (IQ67-domain 2), that interact with the actin binding protein NET3C and form a component of plant EPCS that mediates the link between the actin and microtubule networks. The NET3C-KLCR1-IQD2 module, acting as an actin-microtubule bridging complex, has a direct influence on ER morphology and EPCS structure. Their loss-of-function mutants, net3a/NET3C RNAi, klcr1, or iqd2, exhibit defects in pavement cell morphology, which we suggest is linked to the disorganization of both actin filaments and microtubules. In conclusion, our results reveal a novel cytoskeletal-associated complex, which is essential for the maintenance and organization of cytoskeletal structure and ER morphology at the EPCS and for normal plant cell morphogenesis.

